Nội dung bài viết
Trong hóa học, có sự phân chia thành oxit, axit, bazơ, oxit axit và oxit cơ bản. Mỗi loại sẽ có đặc điểm và tính chất khác nhau. Giống như hôm qua chúng ta đã tìm hiểu oxit là gì, hôm nay mời mọi người theo dõi bài viết của Labvietchem để tìm hiểu về khái niệm. Oxit cơ bản là gì?? Tính chất và đặc điểm của các oxit cơ bản.
1. Khái niệm oxit bazơ là gì?
Oxit cơ bản là các hợp chất gồm một hoặc nhiều nguyên tử kim loại kết hợp với một hoặc nhiều nguyên tử oxy và có bazơ tương ứng. Các oxit bazơ tan trong nước gồm có các kim loại kiềm như Na, K, Li… và các kim loại kiềm thổ như Ba, Ca, Mg… trừ Be.

Tìm hiểu Oxit cơ bản là gì?
Phân loại:
– Oxit bazơ hòa tan là oxit bazơ của bazơ kiềm hoặc bazơ kiềm thổ
– Oxit bazơ không tan là oxit bazơ của các kim loại còn lại như Fe, Cu… và các oxit kiềm khác.
Ngoài ra còn có oxit lưỡng tính và oxit trung tính:
– Oxit lưỡng tính là oxit phản ứng với dung dịch axit và phản ứng với dung dịch bazơ tạo thành muối và nước. Ví dụ Al2O3, ZnO…
– Oxit trung tính là oxit không phản ứng với nước tạo thành axit, bazơ và không phản ứng với bazơ, axit tạo thành muối. Ví dụ CO, KHÔNG…
2. Cách gọi tên các oxit bazơ?
– Tên oxit: tên nguyên tố thêm oxit vào
Ví dụ: NO là Nitơ oxit, BaO là Bari oxit

Cách đọc tên các oxit cơ bản
– Nếu kim loại có hóa trị như Fe có hóa trị II và III thì tên sẽ là tên kim loại có hóa trị + oxit.
Ví dụ cụ thể như sau: FeO đọc là Sắt II oxit, Fe2O3 đọc là Sắt III oxit
– Nếu phi kim có nhiều hóa trị:
Tên oxit sẽ được đọc là tên phi kim (có tiền tố chỉ số nguyên tử phi kim) + oxit (có tiền tố chỉ nguyên tố oxit)
3. Tính chất hóa học cơ bản của oxit bazơ
3.1. Phản ứng với nước
Chỉ có oxit bazơ của kim loại kiềm và kim loại kiềm thổ mới phản ứng được với nước. Các oxit bazơ phản ứng với nước là: K2O, Na2O, CaO, BaO, Li2O, Rb2O, SrO…
Công thức chung được hiển thị dưới đây:
R2On + nH2O -> 2R(OH)n
n là hóa trị của kim loại R
R(OH)n tan trong nước, dung dịch thu được thường gọi là dung dịch bazơ hoặc dung dịch kiềm, dung dịch bazơ hòa tan. Các dung dịch bazơ này thường làm quỳ tím chuyển màu xanh và làm phenolphtalein từ không màu chuyển sang màu hồng.
K2O + H2O -> 2KOH
Na2O + H2O -> 2NaOH
BaO + H2O -> Ba(OH)2
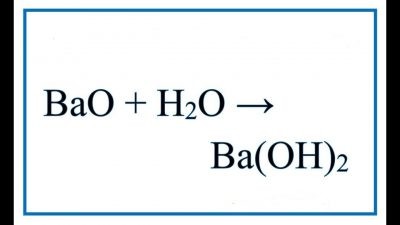
Oxit bazơ phản ứng với nước tạo thành dung dịch bazơ
3.2. Phản ứng với axit
Hầu hết các oxit bazơ đều phản ứng với axit tạo thành muối và nước.
Công thức chung được hiển thị dưới đây:
Oxit bazơ + axit -> Muối + H2O
Ví dụ: ta có phương trình phản ứng sau:
BaO + 2HCl -> BaCl2 + H2O
Fe2O3 + 3H2SO4 -> Fe(SO4)3 + H2O
3.3. Phản ứng với oxit axit
Một số oxit bazơ phản ứng với oxit axit tạo thành muối. Thông thường đây là những oxit phản ứng với nước, có thể nói là hòa tan trong nước.
Công thức được viết như sau:
Oxit bazơ + oxit axit -> Muối
Ví dụ với các phương trình phản ứng sau:
CaO + CO2 -> CaCO3
BaO + SO4 -> BaSO3
4. Các dạng bài tập về oxit bazơ

Bài tập về oxit bazơ
4.1. Mẫu 1 – Xác định công thức oxit bazơ
Bước 1: Nêu công thức oxit bazơ cần tìm cồn trong kim loại cần chỉ ra, nếu không bài toán không chỉ ra kim loại
Bước 2: Tính các số liên hệ
Bước 3: Dựa vào kết quả thu được, viết phương trình hóa học
Bước 4: Thiết lập phương trình hóa học dựa trên phân số theo phương pháp đã thiết lập
Ví dụ: 4,48 gam oxit của kim loại thứ hai phản ứng hoàn toàn với 7,84 gam axit sunfuric H2SO4. Sau đó, xác định công thức của oxit trên.
Hướng dẫn chi tiết cách giải
Gọi tên oxit cần tìm MO vì kim loại đó có hóa trị II
n(H2SO4)= 0,08 mol, n(MO) = 4,48 (M + 16)
Chúng ta có phương trình:
MO + H2SO4 -> MSO4 + H2O
Theo bài toán: 4,48 (M + 16) 0,08 mol
Suy ra: 4,48g (M + 16) = 0,08 => M = 40
Đó là Ca nên oxit ta cần tìm là CaO.
4.2. Dạng 2 – Dạng toán học của oxit bazơ phản ứng với dung dịch axit
Trường hợp 1:
Oxit bazơ + dung dịch axit sunfuric loãng H2SO4 -> Muối sunfat + nước
Ví dụ:
Na2O + H2SO4 -> Na2SO4 + H2O
Nhận xét: Các phản ứng hóa học trên có điểm chung giống nhau: Khi chuyển từ oxit sang muối sunfat, cứ mỗi mol axit sunfuric thêm vào phản ứng thì khối lượng muối tăng lên. Từ đó ta có công thức:
R + 16 gam -> (R + 96) gam -> 1 mol H2O tạo thành hoặc 1 mol H2SO4 tham gia phản ứng. Từ đó ta có công thức:
Muối sunfat = m(oxit) + 80n H2SO4
Hy vọng những thông tin từ labvietchem.com.vn đã giúp bạn hiểu thêm Oxit cơ bản là gì? cũng như công thức chung, cách đọc tên, tính chất và bài tập của oxit cơ bản này. Hãy bình luận nếu bạn có thắc mắc để nhận được câu trả lời.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn