Nội dung bài viết
Tuần qua có nhiều bạn sinh viên hỏi về Labvietchem Phương trình nhiệt phân KClO3 (muối kali clorat) hoặc phương trình nhiệt phân KClO3.5H2O. Vì vậy, trong bài viết hôm nay chúng ta sẽ tìm hiểu về phương trình nhiệt phân muối Kali Clorat và KClO3 cùng với các bài tập ví dụ để học sinh vận dụng tốt nhất trong học tập nhé!
1. Tìm hiểu về muối Kali Clorat KClO3
Trước khi đến phương trình nhiệt phân KClO3, chúng ta cần hiểu tính chất hóa học chung và ứng dụng của muối KClO3.
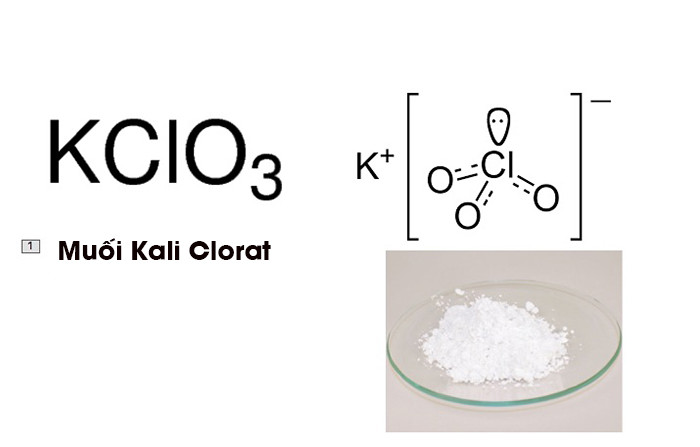
Hình ảnh muối Kali Clorat
Kali Clorat là một hợp chất hóa học có công thức hóa học KClO3, là chất kết tinh màu trắng khi ở dạng tinh khiết. Nó là một hóa chất thường được sử dụng trong công nghiệp và được coi là clorat có nhiều ứng dụng ngày nay.
– KClO3 là chất hóa học mạnh, có thể tác dụng với nhiều phi kim và kim loại như: Cacbon, Lưu huỳnh, Phốt pho, Nhôm, Magiê,…
– KClO3 là chất rắn tan nhiều trong nước nóng, rất ít tan trong nước lạnh và đặc biệt không tan trong rượu
– KClO3 được ứng dụng rộng rãi trong đời sống sinh hoạt và sản xuất công nghiệp, được ứng dụng trong nhiều ngành công nghiệp như pháo hoa, ngòi nổ, que diêm, thuốc làm hoa nhãn.
– KClO3 thường được điều chế bằng cách cho KOH phản ứng với khí clo ở nhiệt độ trên 80 độ C theo phương trình phản ứng sau:
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
– Muối Kali Clorat còn có thể điều chế bằng cách điện phân dung dịch KCl 25% ở nhiệt độ 75 độ C với phương trình phản ứng sau:
2KCl +2H2O → 2KOH + H2 + Cl2 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
2. Cấu trúc phân tử của Kali Clorat
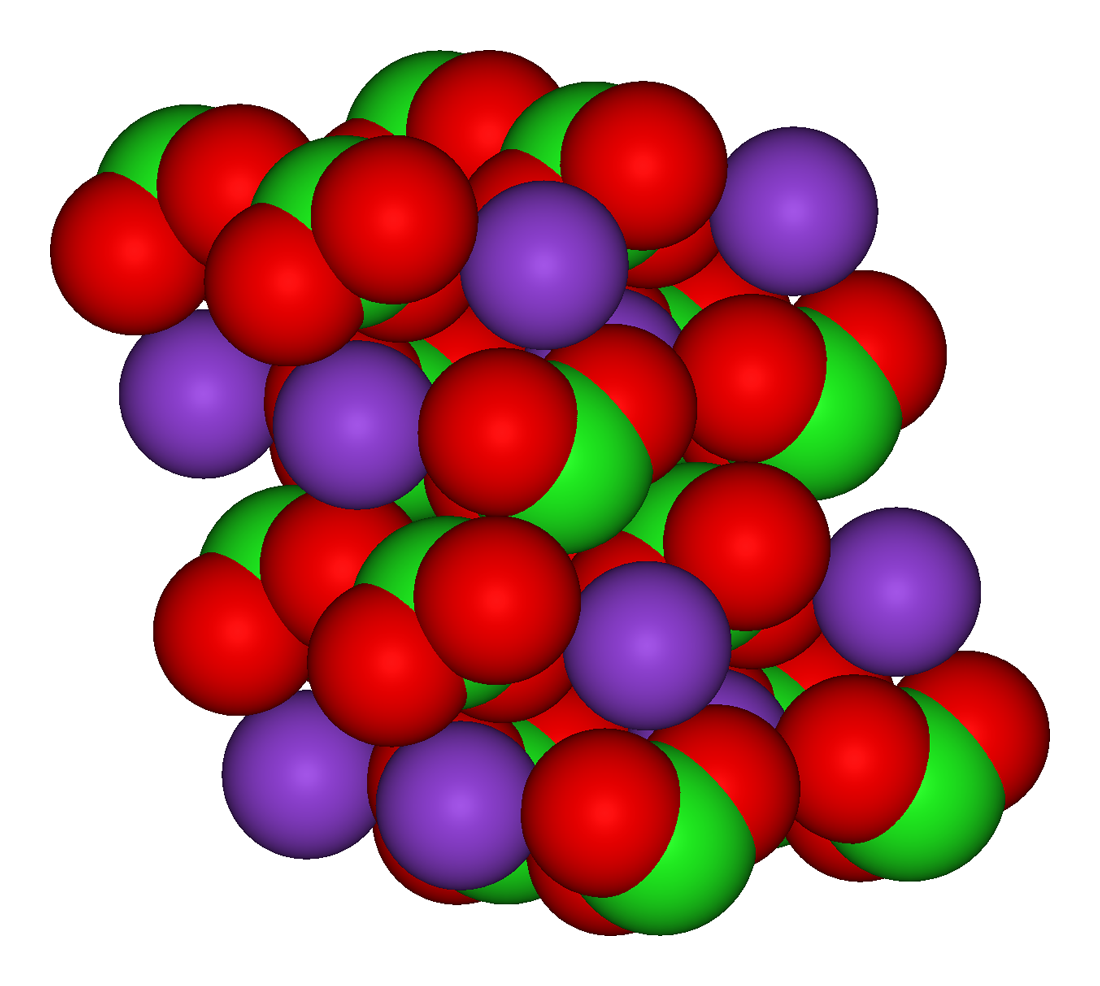
Cấu trúc phân tử của Kali Clorat
3. Tính chất đặc trưng của KClO3
– Ngoại quan: Tồn tại dưới dạng bột hoặc tinh thể màu trắng.
– Khối lượng phân tử: 122,5492 g/mol.
– Khối lượng riêng: 2,32 g/cm3.
– Nhiệt độ nóng chảy ở 356 độ C tương ứng với 629 K hay 673 độ F.
– Nhiệt độ sôi ở 400 độ C tương ứng với 673 K hoặc 752 độ F.
– Độ hòa tan:
+ Trong nước: Độ tan trong nước của KClO3 tăng dần khi nhiệt độ tăng theo bảng sau:
| Nhiệt độ (°C) | Độ hòa tan của KClO3 trong nước (g/100ml) |
| 0°C | 3.13 |
| 10°C | 4,46 |
| 25°C | 8 giờ 15 |
| 40°C | 13.21 |
| 100°C | 53,51 |
| 190°C | 183 |
| 330°C | 29h30 |
+ Hòa tan trong các dung môi khác như glycerol (1g/100g ở 20 độ C).
+ Ít tan trong axeton, amoniac.
+ Không tan trong cồn tuyệt đối.
4. Phương trình nhiệt phân KClO3
– Ở nhiệt độ 400oC phương trình nhiệt phân Kali Clorat KClO3 thành KCl như sau:
4KClO3 → 3KClO4 + KCl (sản xuất kali peclorat và kali clorua)
– Ở nhiệt độ 500oC phương trình nhiệt phân KClO3 thành O2 như sau:
2KClO3 → 2KCl + 3O2 (nhiệt phân tạo ra khí Oxy và muối Kali Clorua)
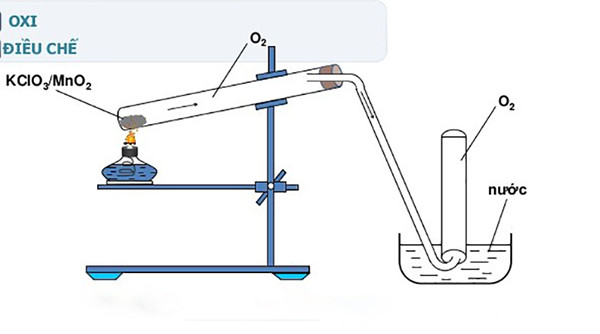
=> Lưu ý: Phản ứng này có thể xảy ra ở nhiệt độ < 500oC nếu chất xúc tác là MnO2 (chất thường dùng để điều chế oxy trong phòng thí nghiệm)
Phương trình nhiệt phân KClO3 được sử dụng để điều chế O2 trong phòng thí nghiệm
Phương trình nhiệt phân KClO3 đơn giản sẽ tạo ra hai loại muối kali (KClO4 và KCl) nếu có chất xúc tác MnO2 hoặc nhiệt độ 500oC sẽ tạo ra khí O2 và muối KCl.
Ngoài KClO3, muối hypoclorit ClO-, muối clorit ClO2- còn có phương trình nhiệt phân sau:
Nhiệt độ 2KClO –> KClO2 + KCl
Nhiệt độ 3KClO2 –> 2KClO3 + KCl
Nhiệt độ 4KClO3 –> 3KClO4 + KCl
Nhiệt độ KClO4 –> KCl + 2O2
5. Ứng dụng của Kali Clorat
– Dùng để chế tạo thuốc nổ, pháo hoa, ngòi nổ và các hỗn hợp dễ cháy khác.

Làm pháo hoa từ Kali Clorat
– Kali clorat được sử dụng trong dược phẩm, chất chụp ảnh, thuốc thử phân tích, chất oxy hóa và tên lửa, chất đẩy tên lửa
– Là chất khử màu trong dệt nhuộm và là chất chống oxy hóa.
– Trong ngành diêm, kali clorat là dược liệu ở đầu que diêm (chứa gần 50% KClO3).

Kali clorat là dược liệu đầu trận
– Trong phòng thí nghiệm, kali clorat được dùng để điều chế oxy dưới dạng phản ứng nhiệt phân với xúc tác là MnO2.
– Ở Việt Nam, kali clorat được sử dụng rộng rãi trong nông nghiệp làm chất điều hòa cây trồng.
6. Muối KClO3 có độc không?
Theo nghiên cứu trên động vật thí nghiệm, đặc biệt là chuột, chất này có liều gây chết người 50% là 1870 mg/kg qua đường uống.
Vì vậy, Kali clorat là một loại muối có thể gây hại cho con người và cần hết sức thận trọng khi sử dụng. Bảo quản đúng nơi, đảm bảo khoảng cách an toàn với trẻ em.
7. Bài tập về phương trình nhiệt phân KClO3
Bài 1: Xét phương trình nhiệt phân: 2KClO3 → 2KCl + 3O2. Tính khối lượng, thể tích khí Oxi thu được sau khi nhiệt phân 73,5g muối KClO3
Giải pháp:
– Ta có: nKClO3 = 73,5/122,5 = 0,6 (mol)
– Theo phương trình hóa học ta có: nO2=3.nKClO3/2 = 3.0.6/2 = 0,9(mol)
– Thể tích khí O2 thu được là: mO2 = nO2.MO2 = 0,9,32 = 28,8 (g)
– Thể tích khí O2 thu được ở điều kiện tiêu chuẩn là: VO2 (điều kiện tiêu chuẩn) = nO2.22.4 = 0.9.22.4 = 20.16 (l)
Bài 2: Nhiệt phân hoàn toàn 24,5g KClO3 thu được 9,6g khí O2 và muối KCl. Tính khối lượng Kali clorua thu được?
Giải pháp:
– Phương trình nhiệt phân KClO3 như sau: 2KClO3 → 2KCl + 3O2
– Theo định luật bảo toàn khối lượng: mKCl = 24,5 – 9,6 = 14,9g
Đun nóng KClO3 tạo ra O2 và KCl
Bài 3: Ta có phương trình nhiệt phân KClO3.5H2O (khi có xúc tác MnO2). Vậy phải nhiệt phân bao nhiêu gam KClO3.5H2O để thu được 6,72 lít O2 (điều kiện tiêu chuẩn)
Giải pháp:
– Phương trình nhiệt phân KClO3.5H2O: KClO3 → KCl + (3/2)O2
+ nKClO3 = O,3:3/2=O,2(mol)
+ nKClO3 = số mol KClO3.5H2O
+ Khối lượng của KClO3.5H2O là: 0,2×212,5=42,5(g)
8. Mua muối Kali Clorat – KClO3 hóa chất phòng thí nghiệm ở đâu uy tín hiện nay?
Nếu bạn đang có nhu cầu mua KClO3 hoặc các hóa chất phòng thí nghiệm khác hãy truy cập ngay website labvietchem.com.vn của Công ty Cổ phần Thiết bị Kỹ thuật LABvietchem – Đây là một trong những sàn giao dịch hàng đầu về lĩnh vực hóa chất, dụng cụ, thiết bị thí nghiệm, phục vụ công việc của các phòng thí nghiệm hóa học, vật lý và sinh học.
– Tại LabTrường Chu Văn An, khách hàng có thể lựa chọn tất cả các loại hóa chất sử dụng trong phòng thí nghiệm, học tập tại các trường đại học, trung học trên toàn quốc.
– Tại LabTrường Lê Hồng Phong bạn sẽ nhận được sự tư vấn về phương trình nhiệt phân KClO3, bài tập hóa học từ các chuyên gia hóa học tốt nghiệp các trường đại học khoa học tự nhiên và bách khoa có nhiều năm nghiên cứu trong lĩnh vực này.
– Tại LabTrường Chu Văn An, hóa chất phòng thí nghiệm có giá TỐT NHẤT thị trường
– Liên hệ 0826 020 020 để nhận được sự hỗ trợ trực tiếp từ chuyên gia
Hi vọng với câu trả lời vừa rồi Phương trình nhiệt phân KClO3 mà LabTrường Lê Hồng Phong chia sẻ sẽ giúp học sinh có thêm nhiều kiến thức ứng dụng được trong bài tập và đạt điểm cao nhất. Hãy truy cập website labvietchem.com.vn thường xuyên để cập nhật những bài viết hay nhất về hóa chất phòng thí nghiệm nhé!
XEM THÊM:
>>> Tìm hiểu cách điều chế khí clo trong phòng thí nghiệm an toàn và hiệu quả
>>> Công thức tính nồng độ phần trăm (C%): Bài tập + Lời giải
>>> Top 3 ứng dụng của dung môi Acetone bạn nên biết
Các tìm kiếm liên quan:
+ Tính KClO3
+ KClO3 + HCl
+ Bài tập nhiệt phân muối clorat
+ Phương trình nhiệt phân KClO3.5H2O


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn