Nội dung bài viết
Quỹ đạo nguyên tử là một khái niệm cốt lõi trong hóa học và vật lý lượng tử, giúp giải thích sự phân bố và hành vi của các electron trong nguyên tử. Việc hiểu rõ quỹ đạo nguyên tử không chỉ giúp chúng ta nắm được tính chất hóa học của các nguyên tố mà còn mở ra nhiều ứng dụng quan trọng trong công nghệ vật liệu, y học và năng lượng. Hãy cùng khám phá chi tiết các loại quỹ đạo, quy luật phân bố electron và tầm quan trọng của chúng trong thực tế nhé!
1. Obitan nguyên tử là gì?
Trong hóa học và vật lý lượng tử, quỹ đạo nguyên tử là một khái niệm quan trọng để mô tả vị trí và hành vi của các electron trong nguyên tử. Obitan nguyên tử không phải là khoảng cách mà một electron di chuyển xung quanh hạt nhân, mà là vùng khó xác định nơi electron có nhiều khả năng xuất hiện nhất.
Khái niệm quỹ đạo nguyên tử được hình thành dựa trên các nguyên lý cơ học lượng tử và được mô tả bằng hàm sóng Schrödinger. Nó cung cấp thông tin quan trọng về cấu trúc nguyên tử và cách các electron tương tác với nhau. Quỹ đạo là một trong những yếu tố cốt lõi giúp giải thích sự sắp xếp và tính chất hóa học của các nguyên tử. Nghiên cứu quỹ đạo giúp dự đoán hình dạng phân tử, phản ứng hóa học và nhiều hiện tượng vật lý khác.
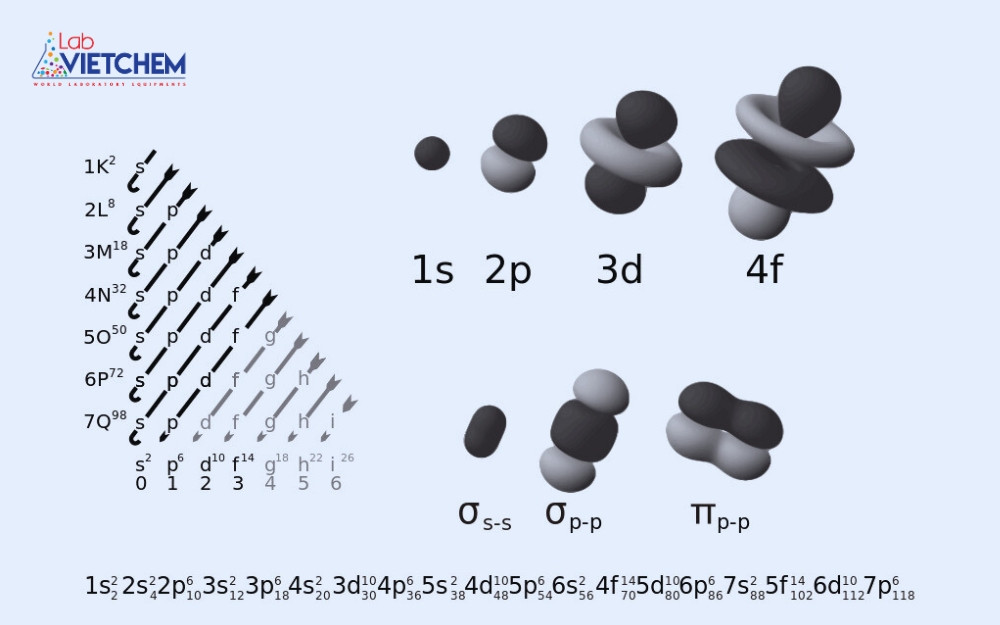
2. Các loại quỹ đạo nguyên tử
Các quỹ đạo nguyên tử được phân loại theo ba số lượng tử quan trọng: số lượng tử chính (n), số lượng tử phụ (l) và số lượng tử từ tính (m). Dựa vào giá trị của l, quỹ đạo nguyên tử được chia thành các loại sau:
2.1. quỹ đạo s
Quỹ đạo s (ký hiệu là l=0) có dạng hình cầu và đối xứng quanh hạt nhân nguyên tử. Mỗi cấp độ n chỉ có một quỹ đạo s. Quỹ đạo s được coi là quỹ đạo có năng lượng thấp nhất trong mỗi nguyên tử, đóng vai trò quan trọng trong việc hình thành các nguyên tử đơn giản như hydro và heli. Các electron ở quỹ đạo s có xác suất xuất hiện cao nhất ở vùng gần hạt nhân, giúp duy trì cấu trúc ổn định của nguyên tử.
2.2. quỹ đạo p
Quỹ đạo p (ký hiệu là l=1) có hình dạng giống thanh, có ba hướng trong không gian: px, py và pz. Các quỹ đạo này xuất hiện từ cấp n=2 trở lên. Chúng đóng vai trò chính trong việc hình thành liên kết của các nguyên tử như carbon, oxy và nitơ. Các nguyên tử có quỹ đạo p có thể hình thành liên kết đôi và liên kết ba, giúp hình thành các phân tử hữu cơ quan trọng như hydrocarbon và các hợp chất hữu cơ khác.
2.3. quỹ đạo d
Quỹ đạo d (được gắn nhãn l=2) có năm biến thể, xuất hiện từ cấp độ n=3. Hình dạng của quỹ đạo d phức tạp hơn quỹ đạo p, đóng vai trò quan trọng trong các nguyên tử kim loại chuyển tiếp. Các nguyên tố kim loại như sắt, đồng và niken có quỹ đạo d góp phần tạo nên tính chất từ, độ bền cơ học và hoạt tính xúc tác trong các phản ứng hóa học.
2.4. quỹ đạo f
Quỹ đạo f (ký hiệu là l=3) có bảy biến thể và bắt đầu xuất hiện ở cấp độ n=4. Quỹ đạo f thường liên quan đến các nguyên tử đất hiếm và Actinide, là thành phần quan trọng trong vật liệu nam châm và các thành phần công nghệ cao. Các nguyên tố như lanthanum và uranium có quỹ đạo f đặc trưng, góp phần ứng dụng vào năng lượng hạt nhân, sản xuất nam châm mạnh và thiết bị điện tử tiên tiến.
3. Quy luật phân bố electron trên quỹ đạo
3.1. Nguyên tắc Aufbau
Nguyên tắc này phát biểu rằng các electron sẽ lấp đầy các quỹ đạo có mức năng lượng thấp trước khi chiếm giữ các quỹ đạo có mức năng lượng cao hơn. Điều này giúp đảm bảo cấu trúc ổn định của các nguyên tử và giải thích tại sao các nguyên tố có tính chất hóa học khác nhau.
3.2. Nguyên lý Pauli
Mỗi quỹ đạo chỉ có thể chứa tối đa hai electron có spin ngược nhau. Nguyên lý này được thành lập dựa trên cơ học lượng tử, đảm bảo rằng không có hai electron nào trong cùng một nguyên tử có cùng bộ số lượng tử.
3.3. Quy tắc Hund
Trong một tập hợp các quỹ đạo có cùng mức năng lượng, các electron sẽ lấp đầy từng quỹ đạo một trước khi ghép đôi. Điều này giúp giảm lực đẩy giữa các electron và tăng tính ổn định của nguyên tử hoặc ion.
4. Ứng dụng của quỹ đạo nguyên tử
4.1. Hóa học lý thuyết
Quỹ đạo nguyên tử giúp giải thích cách các nguyên tử kết hợp để tạo thành phân tử, từ đó giúp dự đoán và mô phỏng các phản ứng hóa học. Nhờ hiểu biết về quỹ đạo, các nhà khoa học có thể dự đoán hình dạng phân tử, tính chất liên kết và khả năng phản ứng của hóa chất.
4.2. Công nghệ vật liệu
Vật liệu bán dẫn: Các quỹ đạo nguyên tử đóng vai trò quan trọng trong việc thiết kế và phát triển vật liệu bán dẫn, được sử dụng trong các mạch điện tử, cảm biến và thiết bị quang học.
Làm cứng động học: Hiểu về quỹ đạo giúp phát triển các hợp kim có tính chất cơ học đặc biệt như thép không gỉ, hợp kim titan và niken.
4.3. Y học và công nghệ nano
Ứng dụng y tế: Các nguyên tử có quỹ đạo đặc biệt được sử dụng trong thiết kế thuốc, chụp ảnh y tế (MRI) và điều trị ung thư bằng liệu pháp hạt nhân.
Công nghệ nano: Quỹ đạo nguyên tử đóng vai trò quan trọng trong nghiên cứu và phát triển vật liệu nano, giúp tạo ra các sản phẩm có tính ứng dụng cao như màng lọc nano, điện cực pin lithium-ion và cảm biến sinh học.
4.4. Kỹ thuật laser và quang học
Hiểu được quỹ đạo nguyên tử giúp thiết kế và tối ưu hóa các nguồn sáng laser cho nghiên cứu khoa học, y học và truyền thông quang học.
Quỹ đạo nguyên tử là một trong những khái niệm quan trọng nhất trong hóa học và vật lý. Nó giúp giải thích và dự đoán tính chất của nguyên tử, phân tử và các phản ứng hóa học. Nghiên cứu quỹ đạo ngày càng được ứng dụng rộng rãi trong nhiều lĩnh vực khoa học công nghệ, từ vật liệu tiên tiến đến y học và năng lượng hạt nhân. Với sự phát triển của công nghệ tính toán và thực nghiệm, sự hiểu biết về quỹ đạo nguyên tử sẽ tiếp tục mở rộng, mang lại những phát minh và cải tiến công nghệ mới trong tương lai.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn