Nội dung bài viết
Natri cacbonat hay còn gọi là soda, có nhiều ứng dụng trong sản xuất gốm sứ, vật liệu thủy tinh,… Na2CO3 có những tính chất đặc trưng nào? Vai trò trong cuộc sống và phương pháp chuẩn bị. Hãy cùng LabTrường Lê Hồng Phong tìm hiểu kỹ hơn qua bài viết dưới đây nhé!
1. Natri cacbonat là gì?
– Tên tiếng Anh của Natri cacbonat là Natri cacbonat hay thường được gọi là soda. Đây là hợp chất muối natri cacbonat, có tính ăn mòn cao, không nên dùng để thay thế muối ăn thông thường.
– Công thức hóa học: Na2CO3.
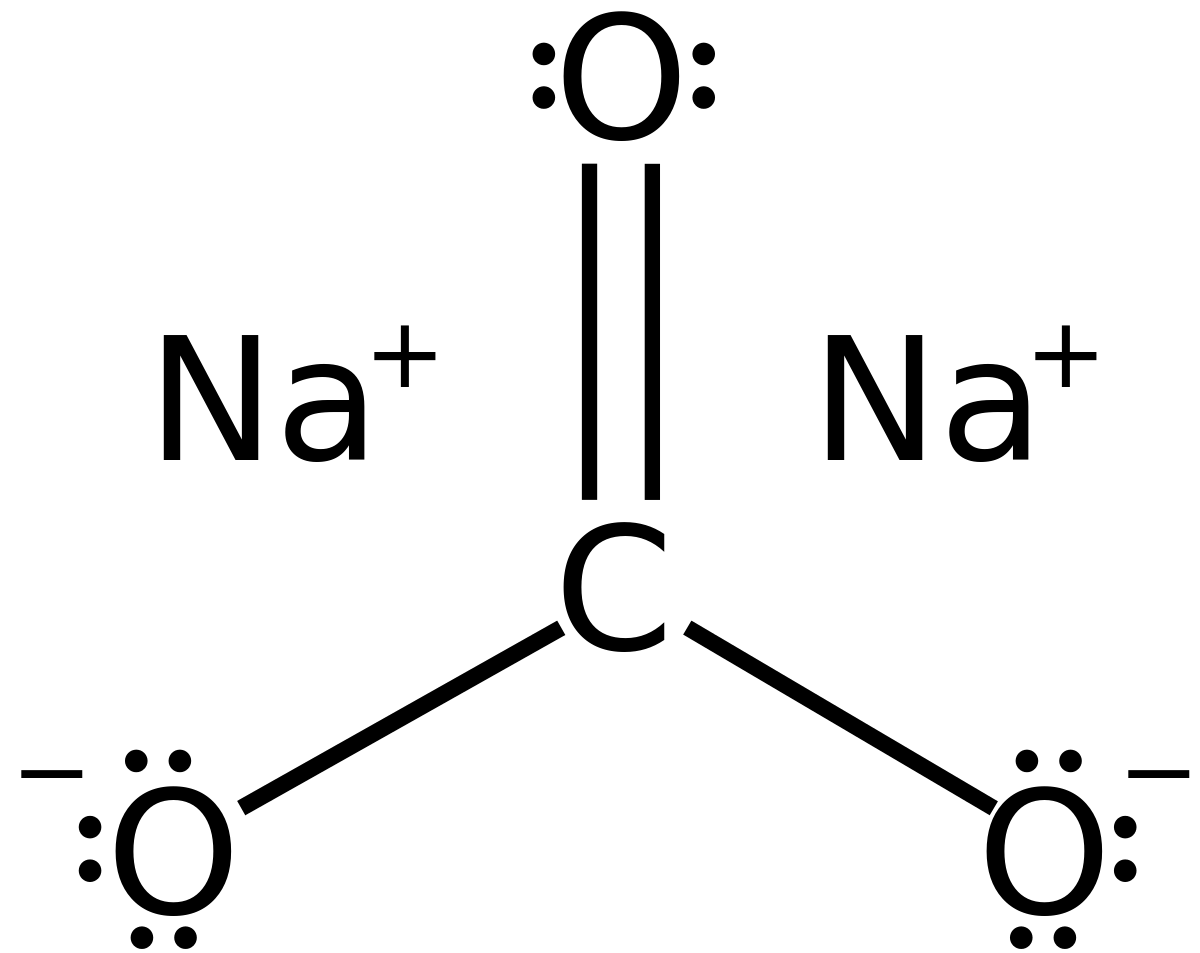
Công thức cấu tạo của Natri cacbonat
– Trong tự nhiên, Na2CO3 là thành phần có trong nước biển, nước khoáng, tro rong biển, muối đá dưới lòng đất.
2. Tính chất hóa lý đặc trưng của Natri cacbonat
2.1. Tính chất vật lý
– Là chất rắn màu trắng, khan, không mùi, có khả năng hút ẩm tốt, khối lượng phân tử 105,9884 g/mol.

Tính chất đặc trưng của Na2CO3
– Tỷ trọng: 2,532 g/cm3, rắn.
– Nhiệt độ nóng chảy: 851°C tương đương 1124 K.
– Nhiệt độ sôi: 1600°C tương ứng 2451 K.
– Nhiệt độ phân hủy: 853°C.
– Độ hòa tan:
+ Tan hoàn toàn trong nước nóng, glycerol, axit sulfuric.
+ Ở 20°C: Độ tan trong nước là 22g/100ml, phản ứng tỏa nhiệt cao.
+ Hòa tan một phần trong Acetone, Alcohol, Metanol.
– Trạng thái giải pháp:
+ Nhiệt độ dưới 32,5°C: Tồn tại ở dạng tinh thể Na2CO3.10H2O.
+ Nhiệt độ từ 32,5 – 37,5°C: Ở dạng Na2CO3.7H2O.
+ Nhiệt độ từ 37,5°C – 107°C: Ở dạng Na2CO3.H2O.
+ Nhiệt độ trên 107°C: Tồn tại ở dạng natri cacbonat khan vì ở nhiệt độ này toàn bộ nước đã bay hơi hết.
– Tính ăn mòn: Ở nồng độ cao Na2CO3 nóng có thể ăn mòn các vật bằng thép.
– Trong không khí, Na2CO3.10H2O thực hiện phản ứng khử nước, khử nước 5 phân tử nước trở thành Na2CO3.5H2O dạng bột màu trắng.
2.2. Tính chất hóa học
– Thể hiện tính chất của bazơ yếu:
+ Trong nước nó sẽ phân ly như sau:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ↔ HCO3− + OH−
+ Làm đổi màu chất chỉ thị: Phenolphtalein từ không màu sang màu hồng nhạt, quỳ tím chuyển sang màu xanh.
– Phản ứng với axit tạo muối mới và giải phóng khí CO2.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2(k)
– Phản ứng với muối tạo ra hai muối mới, trong đó có một muối kết tủa:
Na2CO3 + CaCl2 → 2NaCl + CaCO3 (lượng mưa)
– Tương tác với khí CO2 và nước theo phản ứng thuận nghịch:
Na2CO3 + CO2 + H2O ↔ 2NaHCO3
– Ngoài ra còn phản ứng mạnh với F2, lithium, 2,4,6- trinitrotoluene. Tuy nhiên, không có phản ứng hoặc nguy hiểm nào có thể xảy ra khi kết hợp với các chất sau:
+ Phốt pho pentoxit, florua.
+ Amoniac với bạc nitrat.
+ 2,4,6- trinitrotoluen.
+ Natri sunfat trong nước, hydroroxit.
+ Nhôm có thể làm nhôm nóng chảy phát nổ.
3. Natri cacbonat được sản xuất bằng phương pháp nào?
3.1. Trong tự nhiên
– Natri cacbonat được tìm thấy trong tro của rong biển hoặc các hồ ngầm và mỏ muối, đặc biệt ở những nơi có không khí khô và thung lũng mưa nhiều. Trong tự nhiên, nó thường tồn tại ở dạng Na2CO3.nH2O.
– Người ta tổng hợp Na2CO3 từ quặng đá natri cacbonat. Hiện nay trên thế giới có hơn 60 loại quặng natri cacbonat, được tìm thấy ở nhiều nơi trên thế giới như Botswana, Ai Cập, Ấn Độ, Mexico, Peru, Nam Phi… Nhưng do có nhiều tạp chất trong đó có muối clorua, sunfat… nên quá trình tinh chế khó khăn nên không thể thu được NaCO3 có độ tinh khiết cao.
– Ngoài ra người ta còn khai thác natri cacbonat từ các mỏ muối dưới lòng đất. Để thực hiện quá trình này, người ta cần khoan một cái giếng sâu trong lòng đất rồi đổ nước nóng vào. Khi đó, nước nóng sẽ hòa tan natri cacbonat, đợi đến khi nồng độ đạt 32 độ Bom thì đưa lên mặt nước. Bước tiếp theo là kết tinh và tinh chế để thu được hoạt chất nguyên chất.

Điều chế Na2CO3
3.2. Trong công nghiệp
* Phương pháp Leblanc (phương pháp sunfat)
– Đưa hỗn hợp các chất gồm natri sunfat, than đá và đá vôi đến nhiệt độ 1000 độ C.
Na2SO4 + 2C → Na2S + 2CO2
Na2S + CaCO3 → Na2CO3 + CaS
– Hỗn hợp thu được sẽ được hòa tan với nước rồi lọc để loại bỏ cặn. Phần dư thừa này là CaS vì nó không tan trong nước. Tuy nhiên, chúng ta có thể tận dụng cặn này để sản xuất lưu huỳnh.
* Phương pháp Solvay:
Cho natri clorua phản ứng với amoniac, khí CO2 và nước theo phương trình
NaCl + NH3 + CO2(k) + H2O ↔ NaHCO3 + NH4Cl
Sản phẩm tạo thành NaHCO3 sẽ được tách ra do ít tan trong nước và trải qua quá trình nhiệt phân để tạo ra Na2CO3.
2NaHCO3 ↔ Na2CO3 + CO2(k) + H2O
Các sản phẩm phụ sau đây của quá trình phản ứng có thể được tái sử dụng để sản xuất thêm Na2CO3.
4. Vai trò của Na2CO3 trong cuộc sống
Natri cacbonat là hóa chất được sử dụng phổ biến trong nhiều lĩnh vực, cụ thể như sau:
– Trong công nghiệp: Dùng để sản xuất chất tẩy rửa, chất độn và phụ gia với nhu cầu chiếm khoảng 10-12% sản lượng Na2CO3 trên toàn thế giới. Ngoài ra, nó còn tham gia sản xuất nhiều hợp chất natri như xút, thủy tinh hòa tan, cromat, dicromat,…

Dùng trong sản xuất sản phẩm tẩy rửa
– Lĩnh vực y tế: Dùng để bào chế một số loại thuốc sủi như thuốc nhức đầu,… bằng cách tạo bọt và tăng pH, thuốc giảm đau dạ dày, nước súc miệng,…
– Thực phẩm: Được bổ sung để tăng độ xốp, độ giòn của các loại bánh, món xào… Giúp giảm độ chua, độ chua của nước chanh và nước sốt cà chua. Ngoài ra còn giúp làm mềm món hầm nhanh chóng…
=>Xem thêm: Ứng dụng cơ bản của Natri cacbonat trong công nghiệp
Nếu muốn tìm hiểu thêm về muối natri cacbonat, bạn có thể truy cập website: https://labvietchem.com.vn/ hoặc liên hệ trực tiếp tới hotline để được tư vấn miễn phí.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn