Nội dung bài viết
Metan CH4 là loại khí khá phổ biến trong tự nhiên và được sử dụng rộng rãi làm nhiên liệu. Để hiểu rõ hơn về loại khí này mời các bạn đọc bài viết sau đây của Labvietchem.
1. Tổng quan về Metan CH4 là gì?
1.1. Mêtan là gì? CH4 là gì?
Khí metan hay còn gọi là khí bùn ao hồ có công thức hóa học CH4. Nó là hydrocacbon đơn giản nhất trong dãy tương đồng của ankan.
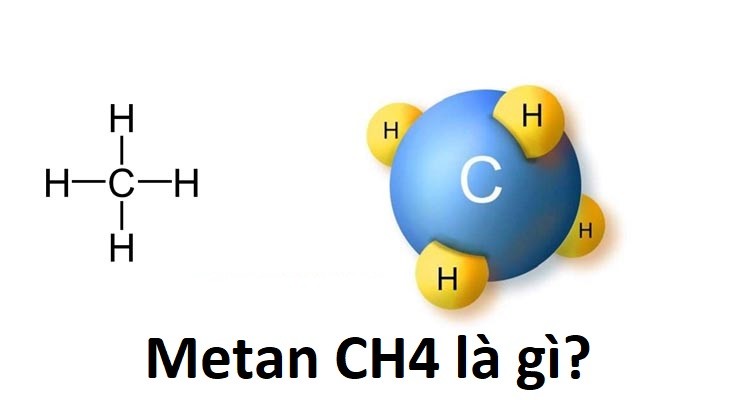
Mêtan CH4 là gì?
1.2. Khí metan có trong tự nhiên ở đâu?
- Khí CH4 có thể xuất hiện trong khí thải phát sinh từ việc đốt nhiên liệu hóa thạch hoặc cháy rừng
- Được tìm thấy trong các quá trình sinh học xảy ra trong ruột động vật, điển hình là quá trình lên men trong ruột và dạ dày của động vật nhai lại
- Được tìm thấy trong quá trình phân hủy kỵ khí ở các hồ, đầm lầy hay trầm tích dưới đáy biển… thậm chí trong bể tự hoại chúng cũng có mặt do hiện tượng lên men kỵ khí.
- Là thành phần chính của khí tự nhiên, đặc biệt là dầu mỏ,
- Có thể tìm thấy trong hang động và giếng sâu.
2. Tính chất lý hóa của metan CH4
2.1. Tính chất vật lý của CH4
- Đây là chất khí không màu, không mùi, không vị
- Rất độc hại và dễ cháy. Khi đốt sẽ tạo ra ngọn lửa màu xanh
- Hóa lỏng ở -162 độ C và đông đặc ở -183 độ C
- Điểm chớp cháy: 537 độ C
- Trọng lượng riêng: 0,717 kg/m3
- Không tan trong dung môi phân cực, chỉ tan trong dung môi không phân cực do thiếu liên kết giữa các hydro
- Không dẫn điện
Khí metan có công thức hóa học CH4
2.2. Tính chất hóa học của metan là gì?
- Tham gia phản ứng thế bằng clo và halogen brom
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
- Phản ứng với hơi nước
CH4 + H2O = CO + H2O (nhiệt độ: 1000 độ C và xúc tác Ni)
- Phản ứng đốt cháy với oxy
+ Phản ứng đốt cháy hoàn toàn:
CH4 + 2O2 → CO2 + 2H2O + Q
Q= -891 kJ/ mol ở 25 độ C, 1 atm
+ Phản ứng đốt cháy không hoàn toàn:
CH4 + O2 → HCHO + H2O (200 atm, 300 độ C)
CH4 + 1/2O2 → CO + 2H2 (500 độ C, Ni)
CH4 + O2 → C + H2O (điều kiện thiếu không khí)
- Phản ứng phân hủy
2CH4 → C2H2 + 3H2
3. Điều chế khí metan CH4 như thế nào?
3.1. Trong phòng thí nghiệm
- Điều chế metan từ cacbua nhôm:
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
- Từ phản ứng của muối natri axetat với xút
CH3-COONa = NaOh → Na2CO3 + CH4 (điều kiện nhiệt độ, xúc tác CaO)
- Bằng phản ứng cộng hydro với cacbon
C + 2H2 → CH4
- Từ khí CO
CO + 3H2 → H2O + CH4 (nhiệt độ)
- Cũng có thể điều chế khí mêtan bằng cách khử các dẫn xuất metyl của halogen, cacbonyl hoặc rượu.
3.2. Trong công nghiệp
Mêtan CH4 và các đồng loại của nó được sản xuất chủ yếu bằng khí tự nhiên và dầu mỏ.

Khí metan có thể được điều chế từ dầu mỏ
4. Ứng dụng khí metan CH4
4.1. Trong việc tạo ra nhiên liệu
- Đây là một trong những nhiên liệu cực kỳ quan trọng. So với đốt than, đốt CH4 sẽ tạo ra ít CO2 hơn trên một đơn vị nhiệt lượng tỏa ra,
- Thường được sử dụng làm nhiên liệu trong các lò nướng, nhà máy, lò nung, bình nước nóng, ô tô,… để đốt oxy tạo nhiệt.
- CH4 ở dạng khí thiên nhiên nén được sử dụng làm nhiên liệu cho các phương tiện giao thông và được đánh giá là thân thiện với môi trường.
- Đóng vai trò quan trọng trong việc tạo ra điện khi đốt làm nhiên liệu trong tua bin khí hoặc máy tạo hơi nước. Ở nhiều nơi, loại khí này còn được gọi là khí tự nhiên dùng để sưởi ấm và nấu ăn.

Mêtan CH4 là gì? Ứng dụng khí Metan làm nhiên liệu cho ô tô
4.2. Trong công nghiệp
- Là nguyên liệu sản xuất nhiều loại hóa chất khác như hydro metanol, anhydrit axetic, axit axetic
- Axetylen cũng có thể được điều chế từ metan
- Tham gia vào nhiều phản ứng hóa học ở các dạng khác nhau: rắn, lỏng, khí
5. Khí mê-tan có nguy hiểm với con người không?
Khí metan CH4 không trực tiếp độc hại nhưng nó cũng mang lại nhiều nguy hiểm cho con người như dễ cháy, nổ. Khi tích tụ quá nhiều sẽ gây ngạt thở hoặc ngộ độc khí CO. Nó có khả năng thay thế oxy trong không khí trong điều kiện bình thường. Gây ngạt thở khi mật độ oxy giảm xuống dưới 18%.
Đây cũng là một trong những chất gây ra hiệu ứng nhà kính, làm trái đất nóng lên, gây nguy hiểm cho con người và các sinh vật khác.
6. Một số bài tập liên quan đến Metan CH4

Bài tập về khí metan
Bài tập 1: Chọn phương trình hóa học đúng trong các phương trình sau:
- a) CH4 + Cl2 → CH2Cl2 + H2 (điều kiện ánh sáng)
- b) CH4 + Cl2 → CH2 + 2HCl (điều kiện ánh sáng)
- c) 2CH4 + Cl2 → 2CH3Cl + H2 (điều kiện ánh sáng)
- d) CH4 + Cl2 → CH3Cl + HCl (điều kiện ánh sáng)
Giải pháp:
Câu trả lời đúng 😀
Bài tập 2: Tính thể tích khí oxi cần thiết và thể tích khí cacbonic sinh ra khi đốt cháy hoàn toàn 11,2 lít khí CH4 (điều kiện tiêu chuẩn). Biết rằng thể tích của tất cả các khí được đo ở STP
Giải pháp:
Chúng tôi có:
nCH4 = 11,2/ 22,4 = 0,5 mol
PTPU:
CH4 + 2O2 → CO2 + 2H2O
Theo phương trình ta có:
nO2 = 2 x nCH4 = 1 x 0,5 = 1mol
nCO2 = nCH4 = 0,5 mol
=> VO2 = 1 x 22,4 = 22,4l
=> VCO2 = 0,5 x 22,4 = 11,2l
Bài tập 3: Thêm hỗn hợp khí gồm khí CO2 và CH4. Hãy trình bày phương pháp hóa học để có thể:
- a) Thu được khí CH4
- b) Thu khí CO2
Giải pháp:
- a) Dẫn hỗn hợp khí qua dung dịch Ca(OH)2 dư. Lúc này khí CO2 sẽ bị giữ lại do phản ứng tạo thành CaCO3. Khí thoát ra khỏi dung dịch là khí CH4 trộn với hơi nước. Sau khi dùng CaO để làm khô ta thu được CH4 tinh khiết.
CO2 + Ca(OH)2 → CaCO3 + H2O
- b) Lấy phần CaCO3 vừa thu được trên cho phản ứng với dung dịch HCl loãng thu được khí CO2. Muốn thu được CO2 tinh khiết bạn chỉ cần làm lạnh và ngưng tụ nước
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Trên đây là những thông tin cơ bản về metan CH4. Vui lòng liên hệ với LabvietCHEM qua đường dây nóng 0826 020 020 nếu bạn có bất kỳ thắc mắc nào liên quan đến hóa chất này. Chúng tôi sẽ nhanh chóng tiếp nhận và đưa ra câu trả lời trong thời gian sớm nhất.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn