Nội dung bài viết
Axit picric là một hợp chất hóa học kết tinh màu vàng, có tính axit mạnh nhất trong phenol. Tên của nó xuất phát từ tiếng Hy Lạp πικρος, có nghĩa là đắng để mô tả hương vị của nó. Đây được coi là chất nguy hiểm vì dễ phát nổ. Vì vậy, bạn cần hiểu rõ tính chất và những lưu ý khi sử dụng để đảm bảo an toàn khi làm việc với axit piric.

Axit piric có nguồn gốc từ tiếng Hy Lạp πικρος
Axit piric là gì?
– Axit picric là hợp chất hóa học có tính axit rất mạnh và tồn tại ở dạng tinh thể rắn màu vàng. Nó được đề cập lần đầu tiên vào năm 1742 trong một bản thảo giả kim của Jonann Rudolf Glauber và được tạo ra bằng cách nitrat hóa một số chất như sừng động vật, lụa, chàm và nhựa tự nhiên.
– Đến năm 1841, axit piric được tổng hợp từ phenol và có công thức hóa học C6H3N3O7, công thức cấu tạo: C6H2(NO2)3OH.
– Tên gọi khác: Axit picric, Axit carbazotic, 2,4,6-trinitrophenol, Phenol trinitrate, Axit Picronitric, Trinitrophenol, 2-Hydroxy-1,3,5-trinitrobenzen,…
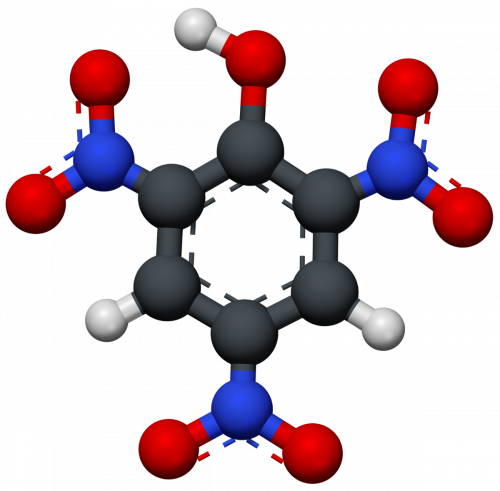
Cấu trúc phân tử của axit piric
Cấu trúc phân tử của axit piric
Tính chất của axit piric
– Axit Piric là chất hóa học kết tủa màu vàng, không mùi nhưng có vị đắng.
– Độ hòa tan trong nước: Hòa tan vừa phải trong nước (12,7 g·L−1)
– Axit picric có tính ăn mòn.
– Dễ nổ.
– Khối lượng mol: 229,10 g·mol−1.
– Mật độ: 1,763 g·cm−3.
– Điểm nóng chảy: 122,5°C (395,6 K; 252,5°F).
– Điểm sôi: > 300°C (573 K; 572°F).
Chuẩn bị axit Picric
Axit picric có thể được điều chế bằng cách nitrat hóa phenol, benzen trong phản ứng Wolfenstein-Boters hoặc thậm chí là axit acetylsalicylic (aspirin).
1. Điều chế axit piric từ Phenol
Cho Phenol phản ứng với dung dịch HNO3 đậm đặc có xúc tác H2SO4 đậm đặc tạo thành nước và axit picric.
C6H5OH + 3HNO3 → 3H2O + C6H2OH(NO2)3
2. Điều chế axit piric từ benzen
Chuỗi phản ứng điều chế axit piric như sau: Benzen -> brombenzen -> phenol -> axit picric.
C6H6 + Br2 -> C6H5Br + HBr (xúc tác FeBr3, nhiệt độ)
C6H5Br + NaOH -> C6H5OH + NaBr (xúc tác áp suất cao, nhiệt độ cao)
C6H5OH + khói HNO3 đậm đặc trong H2SO4 nóng -> C6H5(NO2)3(OH) + 3H2O
Một số lĩnh vực ứng dụng axit piric
1. Trong công nghiệp
Axit picric được sử dụng làm chất nhạy cảm trong ngành nhiếp ảnh.
– Là thành phần của thuốc trừ sâu, thuốc diệt cỏ, thuốc nhuộm…
– Dùng để tổng hợp các chất trung gian hóa học như chloropicrin và axit picramic.
Do tính dễ cháy nên axit piric được sử dụng trong sản xuất diêm và pin.

Dùng trong sản xuất diêm và pin
– Axit piric ẩm được sử dụng trong nhuộm màu da hoặc đánh dấu tạm thời. Khi phản ứng với protein của da, nó sẽ tạo ra màu nâu sẫm có thể tồn tại trong khoảng một tháng.
2. Trong phòng thí nghiệm
– Dùng làm thuốc thử để nhuộm các mẫu vật như nhuộm Gram trong hoạt động dưới kính hiển vi.
– Tạo muối kết tinh của các bazơ hữu cơ (picrate) để nhận biết và xác định các tính chất trong hóa học hữu cơ.
– Dùng trong một số thuốc thử để phân tích nồng độ glucose.
3. Trong quân đội
– Dùng trong sản xuất đạn dược, đạn, bom mìn, vũ khí quân dụng.

Dùng trong sản xuất đạn dược, đạn, bom, mìn
4. Trong y học
– Vào đầu thế kỷ 20, axit piric được sử dụng trong sản xuất dược phẩm như một chất khử trùng, điều trị bỏng, sốt rét, mụn rộp và bệnh đậu mùa.
– Dùng axit picric để xác định nồng độ creatinin trong huyết thanh và nước tiểu.

Sử dụng axit picric để xác định nồng độ creatinine huyết thanh
– Axit picric phản ứng Jaffe tạo thành hỗn hợp có màu phức tạp, có thể đo bằng máy quang phổ để phát hiện creatinine trong thử nghiệm thuốc.
Mức độ nguy hiểm của axit piric
– Axit picric khan nguy hiểm vì là axit mạnh, phản ứng với các kim loại thông thường (trừ nhôm) tạo thành muối, khi cọ xát sẽ phát nổ. Vì vậy, bom, mìn, lựu đạn đều được mạ thiếc hoặc để ngăn axit piric phản ứng với vỏ kim loại.
– Chỉ cần kim loại va chạm nhẹ với axit picric sẽ hình thành muối picrate và điều này rất nguy hiểm.
Axit picric khử nước đặc biệt nguy hiểm, nhất là khi chai chứa nó quá cũ và có nắp kim loại vì phản ứng muối picrate xảy ra và phát nổ.
– Khi bảo quản axit piric trong chai nhựa và axit bên trong đã khô, trên miệng chai có thể hình thành một số tinh thể, khi mở nắp gặp ma sát có thể phát nổ. Cách xử lý trường hợp này là:
+ Mở chai cho vào xô nước (có đá), đặt chai sang một bên và để nước bên trong hòa tan các tinh thể trên đó.
+ Chờ vài ngày cho đến khi thấy nước trong chai rồi mới mở nắp. Nếu bạn không chắc chắn, hãy gọi cho chuyên gia về chất nổ.
Những lưu ý khi làm việc với axit piric
– Giữ ướt axit piric, không mở chai axit mới nếu không có nhu cầu sử dụng. Sau khi mở nên ghi ngày mở nắp để dễ kiểm tra vì mức độ hydrat hóa của loại axit này là 6 tháng. Khi cần thiết, thêm nước cất.
– Không dùng dụng cụ bằng sắt để loại bỏ axit ra khỏi lọ.
– Sau khi lấy hóa chất, dùng khăn ướt lau sạch miệng chai, đặc biệt là các sợi chỉ xoắn ở cổ chai.
– Vứt bỏ các chai axit piric cũ có nắp kim loại.
– Không nên trữ lượng lớn axit picric trong phòng thí nghiệm vì sẽ rất nguy hiểm nếu vô tình phát nổ. Đồng thời, sau 2 năm sử dụng phải thay hóa chất mới.
– Khi làm việc với axit piric phải sử dụng tủ hút. Tốt nhất nên mua dung dịch pha sẵn 1% để sử dụng khi cần thiết.
– Cách xử lý an toàn axit piric: Khử axit bằng natri hydroxit và natri sunfite (Na2SO3). Sau đó hãy vứt bỏ theo quy trình, tuyệt đối không đổ xuống bồn rửa vì có thể phản ứng với ống nước thải kim loại và phát nổ.
Trên đây là một số thông tin về axit piric mà LabENGCHEM muốn chia sẻ tới bạn đọc. Hy vọng qua đó các bạn đã biết cách điều chế và sử dụng axit piric an toàn và hiệu quả.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn