Nội dung bài viết
Dãy điện hóa của kim loại được nhắc đến khá nhiều trong hóa học các cấp. Vậy dãy điện hóa của kim loại là gì và làm thế nào để ghi nhớ hiệu quả? Thông tin chi tiết sẽ được LabvietCHEM tiết lộ dưới đây, mời các bạn cùng tìm hiểu.
1. Dãy điện hóa của kim loại là gì?
Dãy điện hóa của kim loại là dãy kim loại được sắp xếp theo một trật tự, quy luật nhất định. Quy luật này phụ thuộc vào mức độ hoạt động của từng kim loại.

Tìm hiểu dãy điện hóa của kim loại là gì
2. Phạm vi phản ứng hóa học hoàn chỉnh của kim loại
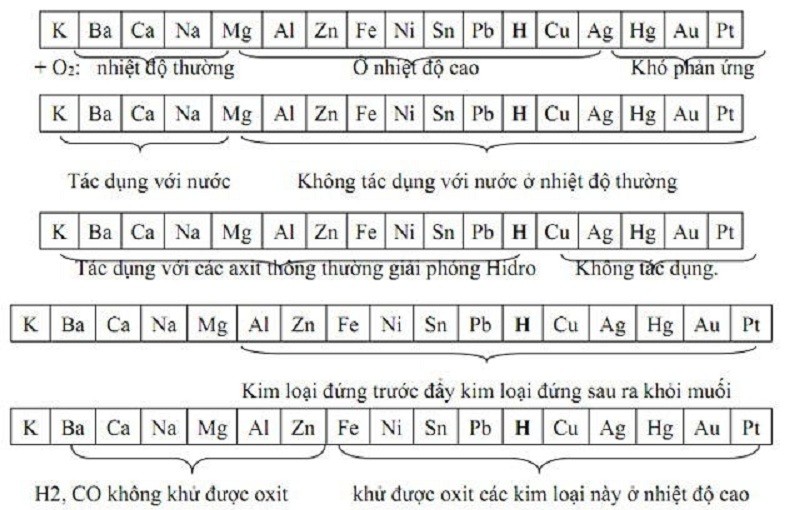
Dãy điện hóa hoàn chỉnh của các kim loại được sắp xếp theo thứ tự tính oxi hóa tăng dần của các cặp oxi hóa khử của kim loại. Đồng thời, tính khử của kim loại sẽ giảm dần. Có thể hiểu đơn giản đây là dãy kim loại có bậc phản ứng giảm dần hoặc mức độ hoạt động hóa học với các chất khác giảm dần.
Ví dụ loạt kim loại Trong bảng tuần hoàn các nguyên tố hóa học như sau: K, Ca, Mg, Al, Zn…

Chuỗi phản ứng hóa học của kim loại
3. Tính chất của kim loại trong dãy điện hóa
dựa vào loạt hóa chất Các tính chất chính của kim loại có thể được gọi là khử và oxy hóa. Cụ thể:
3.1. Tính chất vật lý chung của kim loại
- Linh hoạt, dễ tạo hình và quay.
- Kim loại có tính dẫn điện. Tuy nhiên, nhiệt độ càng cao thì độ dẫn điện càng thấp.
- Độ dẫn nhiệt tốt.
- Kim loại có ánh kim loại.
3.2. Tính chất hóa học chung của kim loại
Tính chất hóa học của kim loại bao gồm:
- Phản ứng với nước
Kim loại nhóm IA và IIA tác dụng với nước. Kết quả là một dung dịch kiềm và khí hydro.
K + 2H2O → 2KOH + H2
- Phản ứng với dung dịch muối
Tính toán kim loại mạnh có thể làm cho kim loại trong muối bị đẩy ra, tạo thành kim loại mới và muối mới.
Fe + CuSO4 → FeSO4 + Cu
- Phản ứng với phi kim
Kim loại tác dụng với phi kim tạo thành muối tương ứng. Đặc biệt, một số phi kim thông dụng kết thúc phản ứng tạo kết tủa muối như: Clo, Oxy, Lưu huỳnh.
4Al + O2 → 2Al2O3
2Fe + Cl2 → 2FeCl3
Hg + S → HgS
- Kim loại tác dụng với dung dịch axit
Kim loại phản ứng với dung dịch axit (với một số trường hợp ngoại lệ). Kết quả là tạo ra muối và giải phóng khí H2.
Fe + 2HCl → FeCL2 + H2
Tính chất hóa học của kim loại
4. Hướng dẫn cách đọc dãy điện hóa dễ nhớ
Chuỗi điện hóa là kiến thức quan trọng giúp giải được nhiều bài tập hóa học vô cơ. Tuy nhiên, dãy điện hóa này có rất nhiều kim loại nên việc ghi nhớ khá phức tạp. Bạn có thể tham khảo nó Cách đọc dãy điện hóa Dễ đọc và dễ nhớ dưới đây:
|
Kim loại |
Cách ghi nhớ cho phù hợp |
|
K Na Ba Ca Mg Al Fe Ni Sn Pb H Cư Hg Ag Pt Âu K Na Ba Ca Mg Al Mn Zn Fe Co Ni Sn Pb H Cu Bi Hg Ag Pt Âu |
Khi nào cần may áo dài? Hỏi người trên đường Cửa hàng Châu Á Châu Phi Châu Âu Không từ biệt chiều mưa ấy Mắt nhìn lối cũ nhớ và chờ đợi Hỏi xem bạn có biết ai không Đường vắng |
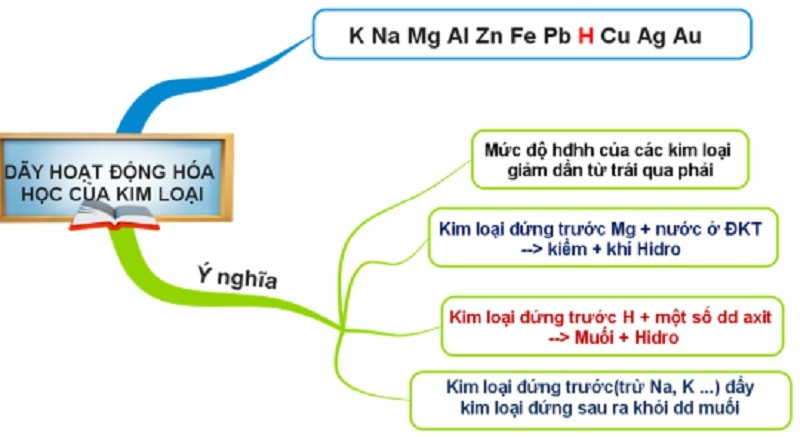
5. Ý nghĩa dãy điện hóa
Ý nghĩa của dãy điện hóa kim loại mang lại nhiều lợi ích khi học tập và áp dụng. Bao gồm:
- Đánh giá phản ứng oxi hóa khử theo quy tắc alpha. Cụ thể, chất khử mạnh phản ứng với chất oxy hóa mạnh sẽ tạo ra chất oxy hóa yếu và chất khử yếu hơn.
- Chuỗi điện hóa dùng để so sánh tính chất oxi hóa khử. Tính oxi hóa của kim loại càng mạnh thì tính khử càng yếu và ngược lại.
- Ý nghĩa của dãy điện hóa kim loại để xác định chiều của phản ứng oxi hóa khử. Chất oxy hóa mạnh sẽ oxy hóa chất khử mạnh, kết thúc phản ứng tạo ra chất khử yếu và chất oxy hóa yếu hơn.
Ý nghĩa dãy điện hóa của kim loại
6. Các bài tập liên quan về dãy điện hóa

Bài tập về dãy điện hóa
Bạn có thể tham khảo một số bài tập về dãy điện hóa dưới đây để áp dụng các phép tính khi cần thiết:
Bài tập 1: Bài tập về dãy điện hóa của kim loại phản ứng với nước
Cho 2 gam kim loại kiềm Na vào rồi hòa tan với nước tạo thành dung dịch NaOH. Vậy sau phản ứng thu được bao nhiêu gam dung dịch kiềm NaOH?
Hồi đáp:
Phương trình phản ứng của Na tác dụng với nước như sau:
2Na + H2O → 2NaOH + H2
Tính số mol Na = 2/46 = 0,043mol. Theo định luật bảo toàn khối lượng thì số mol của Na và NaOH bằng nhau.
Tính số gam NaOH = 0,043 x 80 = 3,44 gam.
Kết luận: Phản ứng tạo ra dung dịch NaOH kiềm có khối lượng 3,44 gam.
Bài tập 2: Bài tập về điện hóa kim loại theo thứ tự.
Cho dãy kim loại dưới đây, dãy nào đúng?
- K Na Ba Ca Mg Al
- Cư Hg Zn Pt Âu
- K Na Fe Ca Mg Al
- Fe Zn Sn Pb H
Câu trả lời đúng là A.
Việc hiểu được cách sắp xếp dãy điện hóa và ý nghĩa của dãy điện hóa này sẽ giúp ích rất nhiều cho việc tính các bài tập liên quan. Hãy lưu lại những chia sẻ trên để áp dụng khi cần thiết. Nếu có thắc mắc về dòng điện hóa kim loại hay hóa chất, vui lòng liên hệ Labvietchem theo số hotline 0826 020 020 để được hỗ trợ nhanh chóng.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn