Nội dung bài viết
Bạn đang tìm kiếm công thức tính pH cho một bài tập hóa học hay cần kiểm soát pH trong sản xuất, bể bơi, bể cá? Độ pH là một chỉ số mạnh mẽ, xác định tính chất của hầu hết các dung dịch xung quanh chúng ta. Trong hướng dẫn đầy đủ này, các chuyên gia hóa học của vietchem sẽ phân tích tất cả các công thức pH từ cơ bản đến nâng cao, kèm theo ví dụ minh họa dễ hiểu và những lưu ý thực tế quan trọng mà bạn không thể bỏ qua.

pH là gì? Tìm hiểu về thang đo pH và tầm quan trọng của nó
Nói một cách đơn giản, pH là thước đo độ axit hoặc độ kiềm (bazơ) của dung dịch. Về mặt hóa học, pH là thang đo logarit của nồng độ ion hydro (H⁺) trong dung dịch.
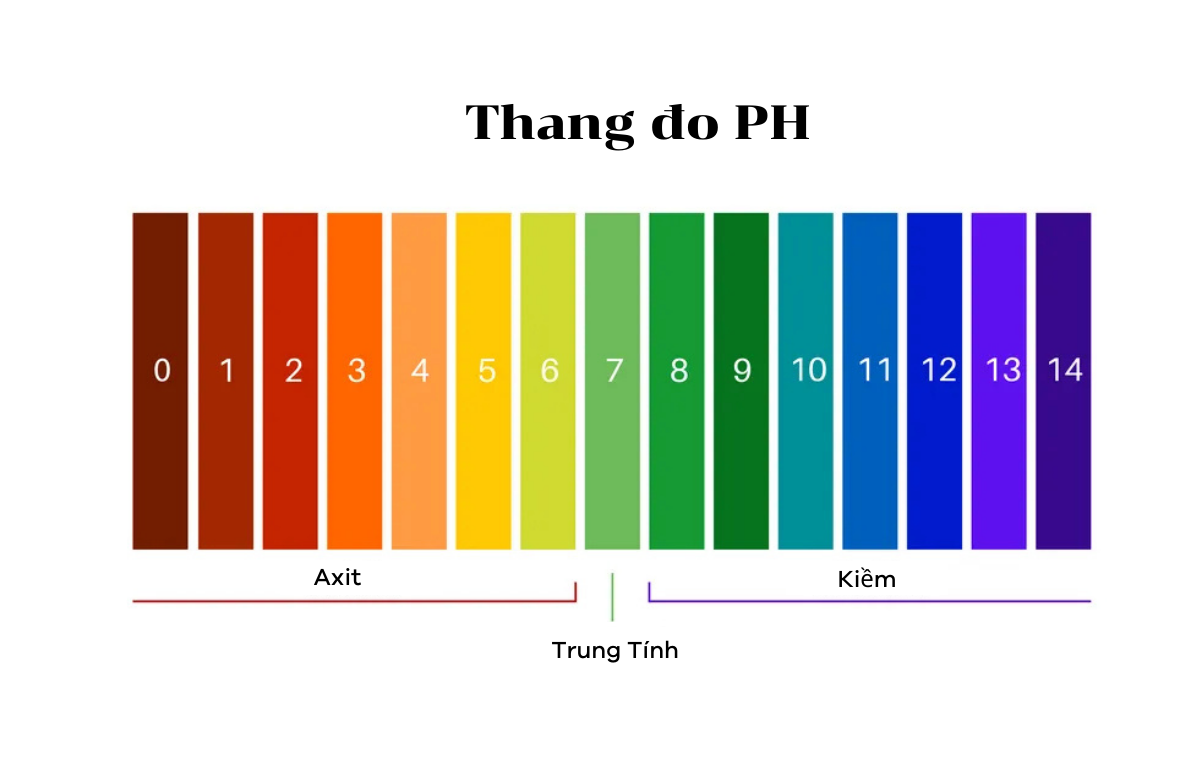
Thang đo pH từ 0-14 có ý nghĩa gì?
Thang đo pH là dãy số chạy từ 0 đến 14, giúp chúng ta xác định nhanh chóng tính chất của dung dịch:
- pH < 7: Môi trường axit. Giá trị pH càng nhỏ thì tính axit càng mạnh.
- pH = 7: Môi trường trung tính. Nước tinh khiết ở 25°C có độ pH xấp xỉ 7.
- pH > 7: Môi trường kiềm (Bazo). Giá trị pH càng lớn thì độ kiềm càng mạnh.
Tại sao việc xác định độ pH lại quan trọng trong thực tế?
Kiểm soát độ pH là cốt lõi trong vô số lĩnh vực:
- Sinh học: Máu người phải duy trì độ pH ổn định khoảng 7,35 – 7,45 để cơ thể hoạt động bình thường.
- Nông nghiệp: Đất cần có độ pH phù hợp để cây trồng hấp thụ chất dinh dưỡng.
- Công nghiệp: Từ sản xuất thực phẩm, dược phẩm đến xử lý nước thải, tất cả đều yêu cầu kiểm soát độ pH nghiêm ngặt.
4+ Công thức tính pH của dung dịch CHÍNH XÁC và dễ áp dụng nhất
Dưới đây là các công thức bạn cần nắm vững, sắp xếp theo cấp độ từ cơ bản đến nâng cao.
1. Công thức tính pH tổng quát và mối quan hệ giữa pH và pOH
Đây là hai công thức cơ bản nhất trong hóa học dung dịch:
- Công thức tính pH:
pH=−log[H+]
- Công thức tính pOH (đo độ kiềm):
pOH=−log[OH−]
Trong đó:
- [H⁺] là nồng độ mol của các ion hydro (mol/L).
- [OH⁻] là nồng độ mol của ion hydroxit (mol/L).
Mối quan hệ vàng: Ở 25°C, pH và pOH luôn liên kết với nhau thông qua hằng số:
pH+pOH=14
Điều này có nghĩa là nếu bạn biết độ pH, bạn có thể dễ dàng tìm ra pOH và ngược lại.
2. Cách tính pH của dung dịch Axit mạnh, Bazơ mạnh (phân ly hoàn toàn)
Axit mạnh và bazơ mạnh là chất điện li mạnh, chúng phân ly hoàn toàn trong nước. Do đó, nồng độ ion H⁺ hoặc OH⁻ sẽ bằng nồng độ ban đầu của axit hoặc bazơ.
- Với axit mạnh: [H⁺] = Cₐ (Cₐ là nồng độ mol của axit)
Ví dụ: Tính pH của dung dịch HCl 0,01M.
- Vì HCl là axit mạnh nên [H⁺] = 0,01 M = 10⁻² M.
- Áp dụng công thức: pH = -log(10⁻²) = 2.
Với cơ sở vững chắc: [OH⁻] = Cₑ (Cₑ là nồng độ mol của bazơ)
Ví dụ: Tính pH của dung dịch NaOH 0,01M.
Vì NaOH là bazơ mạnh nên [OH⁻] = 0,01 M = 10⁻² M.
Chúng ta có: pOH = -log(10⁻²) = 2.
Vậy: pH = 14 – pOH = 14 – 2 = 12.

Phương pháp đo pH
3. Công thức tính nồng độ ph của dung dịch Axit yếu, Bazơ yếu (dựa trên Ka, Kb)
Axit yếu và bazơ yếu chỉ phân ly một phần trong nước. Để tính pH, chúng ta cần sử dụng hằng số phân ly axit (Kₐ) hoặc hằng số phân ly bazơ (Kₐ).
- Công thức tính pH axit yếu:pH = ½ (pKa−logCa)(Với pKₐ = -log(Kₐ) và Cₐ là nồng độ axit)
- Công thức tính pH bazơ yếu:pOH= ½ (pKb−logCb)⟹ pH = 14− pOH (Với pKₐ = -log(Kₐ) và Cₐ là nồng độ bazơ)
4. Công thức tính pH dung dịch đệm (Phương trình Henderson-Hasselbalch)
Dung dịch đệm là dung dịch có khả năng duy trì độ pH gần như không đổi khi thêm một lượng nhỏ axit hoặc bazơ. Đây là một giải pháp cực kỳ quan trọng.
Phương trình Henderson-Hasselbalch:
pH=pKa+log[A−]/[HA]
Trong đó:
- pKₐ là hằng số axit trong hệ đệm.
- [A⁻] là nồng độ của bazơ liên hợp.
- [HA] là nồng độ axit

Công thức tính pH của dung dịch đệm
Tại sao kiểm soát độ pH là một yếu tố quan trọng trong công nghiệp?
Tại Trường Chu Văn An, chúng tôi hiểu rằng việc tính toán và kiểm soát độ pH không chỉ là lý thuyết. Đó là yếu tố quyết định chất lượng sản phẩm và hiệu quả sản xuất. Ví dụ:
- Xử lý nước thải: Phải điều chỉnh pH về khoảng trung tính (6,5 – 8,5) trước khi xả thải để bảo vệ môi trường và tuân thủ quy định.
- Ngành thực phẩm: Độ pH ảnh hưởng trực tiếp đến hương vị, màu sắc và thời gian bảo quản của các sản phẩm như sữa chua, nước ngọt, thực phẩm đóng hộp.
- Sản xuất mỹ phẩm: Da người có độ pH hơi axit (khoảng 5,5). Các sản phẩm chăm sóc da phải có độ pH tương thích để không gây kích ứng và bảo vệ hàng rào tự nhiên của da.
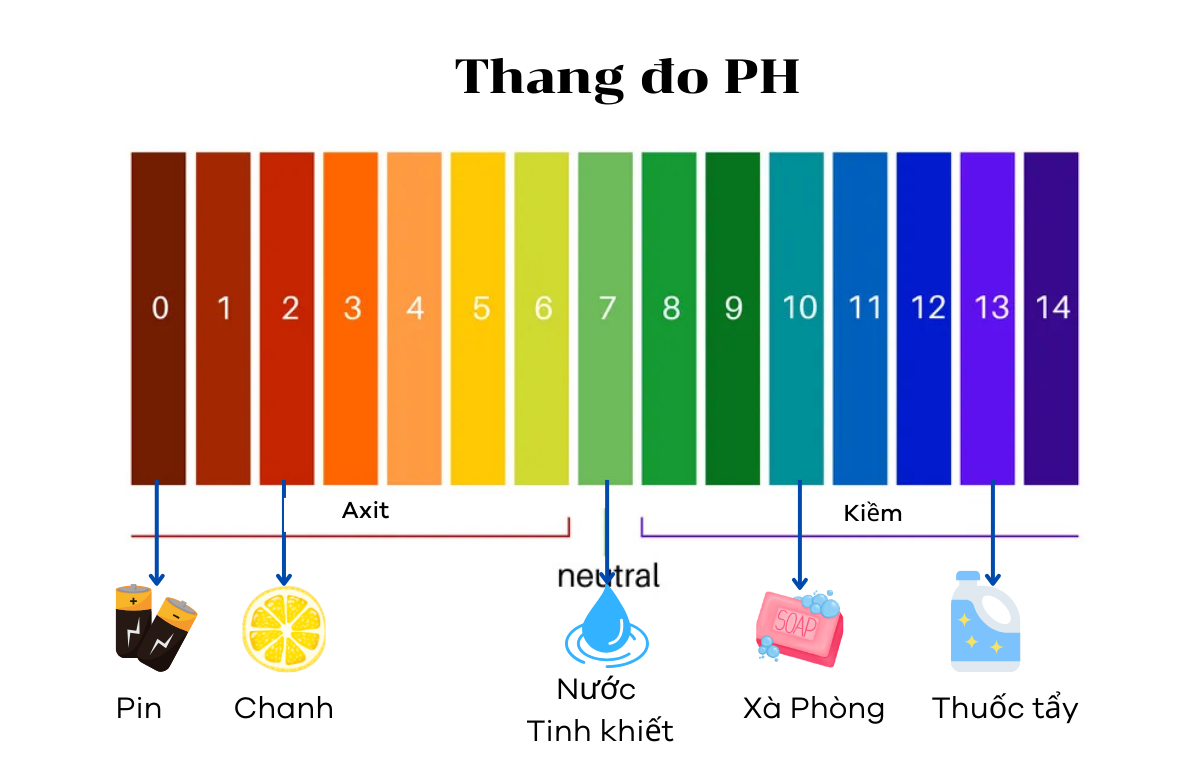
Bảng màu và giá trị pH của các dung dịch thông dụng
Để dễ hình dung, bạn có thể tham khảo bảng giá trị pH của một số dung dịch quen thuộc trong cuộc sống.
|
Giải pháp |
Giá trị pH (ước tính) |
|
Axit pin |
< 1,0 |
|
Nước dạ dày |
1,5 – 3,5 |
|
nước chanh |
2.4 |
|
Giấm |
2.9 |
|
Cà phê |
5.0 |
|
Sữa tươi |
6,5 |
|
Nước tinh khiết |
7,0 |
|
Máu người |
7h35 – 7h45 |
|
Nước |
8,0 |
|
xà phòng |
9,0 – 10,0 |
|
Amoniac (NH₃) |
11.0 |
|
Thuốc tẩy (Javen) |
12,5 |
|
Xút (NaOH) |
14.0 |
Giải đáp các câu hỏi thường gặp khi tính pH (FAQ)
Làm thế nào để tính pH từ pOH và ngược lại?
Sử dụng công thức pH + pOH = 14 (ở 25°C). Nếu bạn có pOH = 3 thì pH = 14 – 3 = 11.
Các phương pháp đo pH phổ biến hiện nay là gì?
Có hai phương pháp chính:
- Chỉ thị màu: Dùng giấy quỳ hoặc dung dịch chỉ thị, so màu để ước tính khoảng pH. Nhanh, rẻ nhưng kém chính xác.
- Máy đo pH: Sử dụng điện cực chuyên dụng cho kết quả có độ chính xác cao, đạt tiêu chuẩn trong phòng thí nghiệm và nhà máy.
Cần lưu ý điều gì để tính toán và đo pH cho kết quả chính xác?
Nhiệt độ ảnh hưởng đến giá trị pH. Hầu hết các tính toán và thang đo tiêu chuẩn đều dựa trên nhiệt độ 25°C. Khi đo cần hiệu chuẩn máy đo pH bằng dung dịch đệm chuẩn để đảm bảo độ chính xác.
Kết luận
Nắm vững các công thức pH là một kỹ năng cần thiết đối với bất kỳ ai làm việc trong lĩnh vực hóa học, sinh học và các ngành liên quan. Từ các công thức cơ bản đến phương trình Henderson-Hasselbalch phức tạp, mỗi công thức mở ra cánh cửa hiểu biết và kiểm soát thế giới hóa học xung quanh chúng ta.
Nếu bạn cần tư vấn về dung dịch đệm chuẩn, hóa chất công nghiệp hay thiết bị đo lường chuyên dụng cho phòng thí nghiệm, nhà máy, hãy liên hệ ngay với vietchem để nhận được giải pháp tối ưu và hỗ trợ chuyên nghiệp nhất!
Nguồn tham khảo: Các khái niệm và công thức được so sánh với định nghĩa của Liên minh Hóa học thuần túy và ứng dụng quốc tế (IUPAC).


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn