Nội dung bài viết
Khi nghiên cứu các chất, hợp chất chắc chắn bạn sẽ thấy yếu tố hòa tan trong tính chất vật lý. Vì thế Độ hòa tan là gì?? Công thức tính độ tan, yếu tố nào ảnh hưởng đến độ tan? Hãy cùng LabTrường Lê Hồng Phong đi tìm câu trả lời trong bài viết hôm nay nhé.
A/ Chất hòa tan và chất không hòa tan
Thí nghiệm về chất hòa tan và không hòa tan
Tiến hành thêm Canxi cacbonat CaCO3 và Natri clorua NaCl vào 2 cốc nước khác nhau. Kết quả là CaCO3 không tan trong nước và NaCl tan trong nước. Điều này chứng tỏ có chất hòa tan, cũng có chất không hòa tan trong nước, có chất hòa tan nhiều hơn, có chất hòa tan kém hơn.
Độ hòa tan của muối, axit, bazơ trong nước
– Hầu hết các axit đều tan trong nước, trừ axit silicic (H2SiO3).
– Hầu hết bazơ đều không tan trong nước, trừ một số bazơ kim loại kiềm như NaOH, KOH, Ba(OH)2,… Ca(OH)2 ít tan.
– Tất cả các muối natri và kali đều tan được.
– Tất cả các muối nitrat (-NO3) đều tan tốt trong nước.
– Hầu hết các muối clorua (-Cl) và sunfat (=SO4) đều hòa tan, còn muối cacbonat (=CO3) hầu hết không hòa tan.
B/ Độ hòa tan là gì?
Độ hòa tan là đại lượng đặc trưng cho khả năng hòa tan của chất rắn, chất lỏng hoặc chất khí trong dung môi để tạo ra dung dịch đồng nhất. Ngoài ra, theo công thức tính độ tan còn được hiểu theo nghĩa là số gam chất đó hòa tan trong 100g dung dịch (nước) để tạo ra dung dịch bão hòa ở điều kiện nhiệt độ môi trường quy định.
Dựa vào khả năng hòa tan của một chất trong nước người ta chia chất đó thành 3 loại sau:
+ Chất tan/hòa tan: 100g nước có thể hòa tan được trên 10g chất.
+ Chất ít tan: 100g nước có thể hòa tan ít hơn 1g chất.
+ Chất không tan: 100g nước có thể hòa tan ít hơn 0,01g chất.
C/ Công thức tính độ tan
Công thức tính độ hòa tan được xác định cụ thể như sau:
S = (mct/mdm) x 100
Trong đó:
- mct là khối lượng chất tan
- mdm là khối lượng dung môi
- S là độ hòa tan
Thông qua công thức hòa tan, chúng ta có thể xác định mối quan hệ giữa độ hòa tan của một chất và nồng độ phần trăm của dung dịch bão hòa ở nhiệt độ nhất định, đó là:
C = 100 x S/ (100+S)
Độ hòa tan càng thấp thì chất đó càng ít tan và ngược lại.
D/ Các yếu tố ảnh hưởng đến độ hòa tan của một chất
-
Nhiệt độ
– Đối với chất khí, nhiệt độ càng cao thì độ hòa tan của chúng trong dung môi càng thấp. Vì vậy, chúng ta có thể đun nóng để loại bỏ các khí như O2, CO2 ra khỏi dung môi mà không làm biến đổi hay phân hủy chất mà vẫn giữ được tính ổn định của thuốc.
– Đối với chất rắn hấp thụ nhiệt khi hòa tan thì nhiệt độ càng cao thì khả năng hòa tan càng lớn.
– Đối với những chất rắn khi hòa tan tỏa nhiệt thì nhiệt độ càng cao thì độ hòa tan càng thấp.
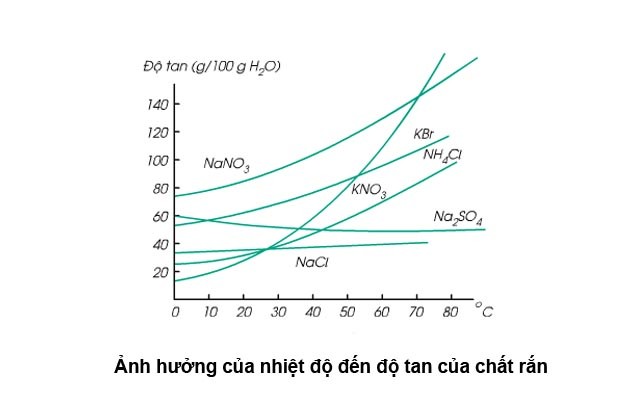
Nhiệt độ ảnh hưởng đến độ hòa tan
-
Áp suất (đối với khí)
Theo định luật Henry, trong trường hợp chất khí có độ hòa tan thấp và áp suất không quá cao thì lượng khí hòa tan trong một thể tích chất lỏng xác định tỷ lệ thuận với áp suất của nó lên bề mặt chất lỏng ở nhiệt độ không đổi. Vì vậy, khi áp suất tăng thì độ hòa tan của khí tăng và ngược lại.
-
Độ phân cực của chất tan và dung môi
– Các chất phân cực dễ tan trong các dung môi phân cực như nước, dung dịch muối, kiềm, axit vô cơ,..
– Các chất ít phân cực dễ tan trong các dung môi hữu cơ ít phân cực như diclometan, benzen, toluen, cloroform,…
-
Dạng vô định hình
– Độ tan của chất rắn vô định hình lớn hơn độ tan của chất rắn kết tinh. Nguyên nhân là do cấu trúc mạng tinh thể ở dạng tinh thể tương đối ổn định nên cần nhiều năng lượng để phá vỡ cấu trúc hơn ở dạng vô định hình. Tuy nhiên, chất rắn vô định hình không ổn định bằng chất rắn kết tinh và chúng thường có xu hướng quay trở lại dạng tinh thể.
-
Hiện tượng hydrat hóa
Trong quá trình kết tinh, chất rắn có thể tồn tại ở dạng khan hoặc ngậm nước. So với dạng ngậm nước, độ hòa tan của chất rắn khan lớn hơn.
-
Hiện tượng đa hình
Tùy thuộc vào điều kiện kết tinh, một chất rắn có thể kết tinh thành nhiều dạng tinh thể khác nhau như tinh thể hydrat, đồng tinh thể, v.v. với các tính chất vật lý và độ hòa tan trong dung môi khác nhau. Các tinh thể kém ổn định hơn sẽ cần ít năng lượng hơn để phá vỡ cấu trúc của chúng, do đó chúng hòa tan dễ dàng hơn. Tuy nhiên, những tinh thể này có xu hướng chuyển sang dạng ổn định hơn và làm giảm độ hòa tan của chất rắn.
-
pH của dung dịch
– Nếu dung môi có tính kiềm thì độ hòa tan của axit yếu sẽ tăng.
– Nếu dung môi bị axit hóa thì khả năng hòa tan của kiềm yếu sẽ tăng lên.
– Với các chất lưỡng tính, pH càng gần điểm đẳng điện thì độ hòa tan càng thấp và ngược lại.
-
chất điện giải
Chất điện phân trong dung dịch có thể làm giảm độ hòa tan của chất tan nên bạn cần pha loãng chất điện phân trước khi cho vào dung dịch.
-
Ion cùng tên
Khi tăng nồng độ các ion cùng tên, cân bằng điện phân của chất tan sẽ chuyển dịch về dạng phân tử ít tan và làm giảm độ tan của chất đó. Vì vậy, khi hòa tan cần hòa tan chất ít tan trước, sau đó mới hòa tan chất tan nhiều hơn.
-
Hỗn hợp dung môi
Khi kết hợp các hỗn hợp dung môi tan trong nước như glycerin-etanol-nước thì khả năng hòa tan của các chất kém tan sẽ tăng lên.
E/ Bảng độ hòa tan hóa học của muối, axit, bazơ
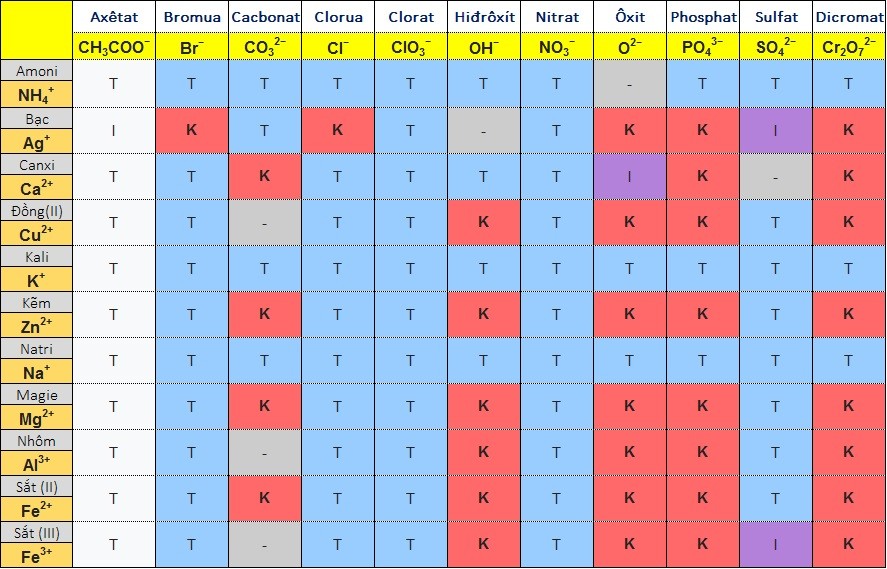
Bảng độ hòa tan hóa học của muối, axit, bazơ
Ghi chú:
- T là chất hòa tan
- Tôi hòa tan một cách tiết kiệm
- K là chất không hòa tan (hộp màu xanh).
- B là chất dễ bay hơi
- (-) là chất không tồn tại hoặc bị phân hủy bởi nước
F/ Hướng dẫn cách đọc bảng độ tan – Cách ghi nhớ bảng độ tan
Bảng độ hòa tan bao gồm các hàng (anion bazơ axit (hoặc OH-)) và cột (cation kim loại). Với mỗi chất cụ thể, chúng ta sẽ xác định ion dương và ion âm, sau đó sắp xếp các hàng, cột tương ứng để biết trạng thái của chất đó trong một ô.
Cách ghi nhớ bảng độ tan:
|
hợp chất |
Thiên nhiên |
Ngoại trừ |
|
Axit (xem cột H+ và anion axit tương ứng) |
Tân |
H2SiO3 |
|
Các bazơ (xem hàng ion OH- và cation tương ứng) |
Không hòa tan |
LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2, NH4OH. |
|
– Muối liti – Muối natri – Muối kali – Muối amoni |
Tân |
|
|
muối bạc |
Không hòa tan (AgCl) |
AgNO3, CH3COOAg. |
|
– Muối nitrat – Muối axetat |
Tân |
|
|
– Muối clorua – Muối bromua – Muối iod |
Tân |
AgCl: kết tủa trắng AgBr: kết tủa màu vàng nhạt AgI: kết tủa vàng PbCl2, PbBr2, PbI2 |
|
muối sunfat |
Tân |
BaSO4, CaSO4, PbSO4: kết tủa trắng Ag2SO4: ít tan |
|
– Muối sunfit – Muối cacbonat |
Không hòa tan |
Trừ muối kim loại kiềm và amoni NH4+ |
|
muối sunfua |
Không hòa tan |
Trừ muối của kim loại kiềm, đất kiềm và amoni NH4+ |
|
Muối photphat |
Không hòa tan |
Trừ muối bằng Na+, K+ và amoni NH4+ |
Qua bài viết trên chắc hẳn các bạn đã biết độ hòa tan là gì cũng như công thức tính độ hòa tan và bảng độ hòa tan của muối, axit, bazơ. Hy vọng với những thông tin này từ labvietchem các bạn sẽ có thêm kiến thức để học hóa học tốt hơn.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn