Nội dung bài viết
Khi làm quen với hóa học, có lẽ mol, nồng độ mol là những thuật ngữ mà học sinh sẽ gặp rất nhiều trong các bài học. Và đó cũng chính là kiến thức đầu tiên mà học sinh phải nắm vững để bắt đầu chinh phục hóa học. Vậy số mol và nồng độ mol là gì? Làm thế nào để tính toán nốt ruồi? Hãy cùng LabTrường Lê Hồng Phong tìm hiểu những kiến thức thú vị về nốt ruồi qua bài viết sau đây nhé!
Cách tính số mol
Mol là gì?

Mol là gì?
Trước khi tìm hiểu cách tính mol chúng ta cần biết khái niệm mol là gì?
– Theo wikipedia, Mol hay mol (ký hiệu: mol), là đơn vị đo dùng trong hóa học để mô tả lượng một chất có chứa 6.022.1023 số lượng hạt nguyên tử hoặc phân tử của chất đó. Số 6,02214129(27)×1023 – gọi là hằng số Avogadro (ký hiệu NA), giống như 1 mol sắt – Fe hay 6,1023 nguyên tử Fe.
– Mol là một trong những đơn vị cơ bản của hệ SI cho các hạt cực nhỏ. Trong các phép biến đổi đại lượng, ta có thể làm tròn: N = 6.023,1023.
– Tùy theo cách lựa chọn hạt đơn vị mà người ta chia mol thành hai loại là mol nguyên tử và mol phân tử.
+ Mol của một nguyên tố là lượng nguyên tố đó chứa nguyên tử NA của nguyên tố đó, ví dụ 1 mol nguyên tử kali sẽ có 6,02×1023 nguyên tử K.
+ Số mol của một chất là lượng phân tử NA của chất đó. Ví dụ: 1 mol phân tử oxy sẽ có 6,022×1023 phân tử khí oxy.
nồng độ mol là gì?

nồng độ mol là gì?
Dung dịch chứa cả chất hòa tan và chất không hòa tan. Lượng chất tan trong một thể tích dung môi cố định càng lớn thì nồng độ càng cao. Nồng độ này sẽ đạt giá trị cực đại khi dung dịch bão hòa, nghĩa là chất tan khó có thể hòa tan thêm nữa trong dung dịch. Nếu bạn vẫn cố gắng thêm chất tan, quá trình kết tinh phân tử sẽ xảy ra, dẫn đến các pha cùng tồn tại hoặc tạo ra huyền phù (huyền phù).
– Thể tích mol (M) (nồng độ phân tử) biểu thị số mol của một chất tan nhất định trong 1 lít dung dịch chẳng hạn như trong 5 lít dung dịch chứa 3 mol hạt chất tan tạo thành dung dịch 0,6 M hay còn gọi là 0,6 mol. Sử dụng mol có nhiều ưu điểm vì nó cho phép đo được số lượng tuyệt đối các hạt có trong dung dịch, bất kể khối lượng và thể tích của chúng.
– Nồng độ mol hay nồng độ mol khối lượng (m) biểu thị số mol của một chất cho trước trong 1 kg dung môi chẳng hạn như 4 kg dung môi chứa 3 mol hạt hòa tan tạo thành dung dịch có nồng độ 0,75 mol/kg hay còn gọi là “0,75 mol”.
– Nồng độ khối lượng mol không đổi theo nhiệt độ và liên quan đến khối lượng dung môi hơn là thể tích dung dịch. Do đó, nồng độ mol khối lượng là một hằng số không chắc chắn, không phụ thuộc vào nhiệt độ và áp suất. Còn nồng độ mol thể tích sẽ tăng khi nhiệt độ giảm.
Các cách tính số mol
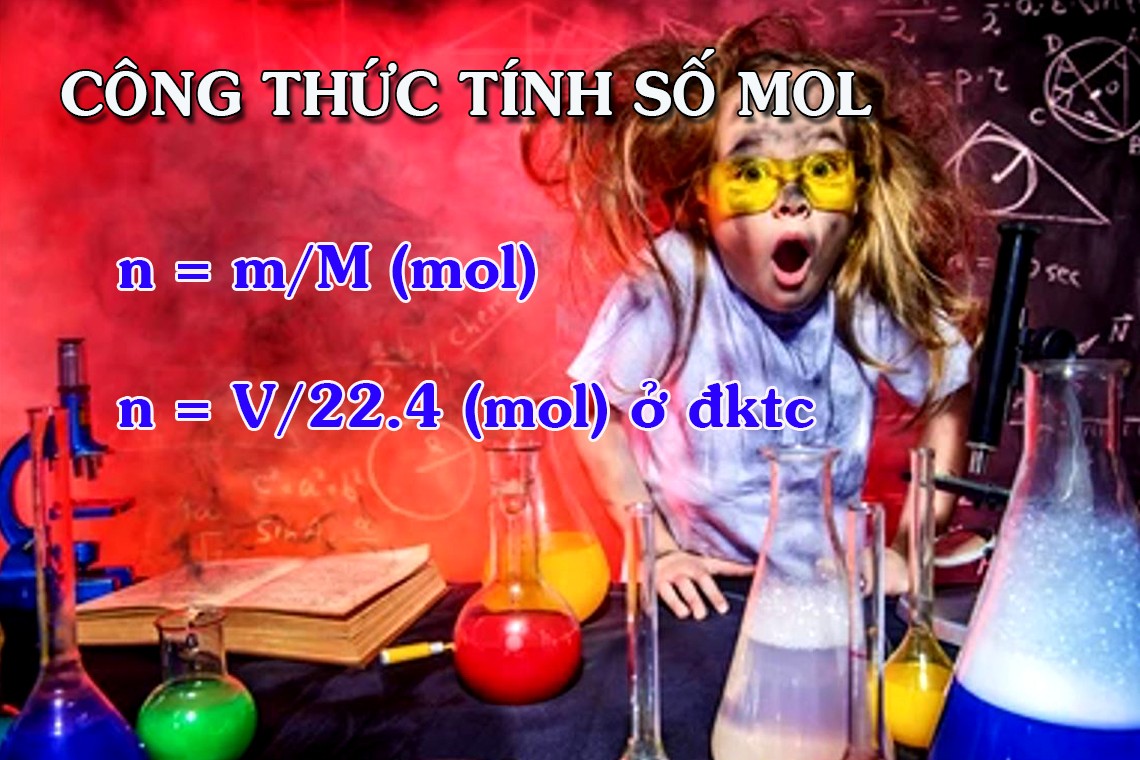
Công thức tính số mol nguyên tử, phân tử
+> Cách tính số mol nguyên tử, phân tử theo khối lượng
n = m/M
trong đó:
- n là số mol chất (mol).
- M là khối lượng mol (g/mol): Là khối lượng mol của chất đó được tính bằng gam N phân tử hoặc nguyên tử của chất đó. Khối lượng mol bằng khối lượng mol hoặc khối lượng mol của chất đó như khối lượng mol của nguyên tử cacbon – C là 12 g/mol, khối lượng mol của phân tử amoniac – NH3 là 17 g/mol.
Bạn cần lưu ý rằng khối lượng mol của nguyên tử và phân tử không giống nhau. Ví dụ: khối lượng mol của phân tử Nitơ – N2 là 28 g/mol và khối lượng mol của nguyên tử Nitơ – N là 14 g/mol
- m là khối lượng của chất đó (g).
+> Cách tính số mol một chất khí ở điều kiện tiêu chuẩn (điều kiện tiêu chuẩn)
– Thể tích mol của các chất khí ở cùng điều kiện nhiệt độ và áp suất bằng nhau
– 1 mol khí có thể tích 22,4 lít ở 0 độ C, 1 atm, tức là VH2 = VO2 = VSO2 = VN2 = 22,4 lít.
– 1 mol khí có thể tích 24 lít ở điều kiện phòng 20 độ C, 1 atm.
Công thức tính số mol khí (nhiệt độ tiêu chuẩn)
n = V/22,4
trong đó
- n là số mol khí (mol).
- V là thể tích khí ở điều kiện tiêu chuẩn (lít).
- 22,4 là không đổi ở điều kiện tiêu chuẩn.
Trong trường hợp các chất khí ở trạng thái tự nhiên, điều kiện khác với điều kiện tiêu chuẩn thì bạn không thể sử dụng công thức trên mà cần có những công thức, phép tính phức tạp hơn.
Cách tính số mol dư
Loại vấn đề có dư lượng sau phản ứng. Bài toán sẽ chỉ ra lượng hai chất tham gia phản ứng và yêu cầu tính lượng chất tạo thành. Trong 2 chất tham gia, có 1 chất phản ứng hoàn toàn, chất còn lại phản ứng được.
Các bước giải bài toán tính số mol thừa:
Bước 1: Tính số mol (quy đổi lượng chất thành số mol).
B2: Viết và cân bằng các phương trình hóa học:
aA + bB → cC + dD
Bước 3: So sánh các tỷ số: (nA, nB lần lượt là số mol của A và B)
+ => A và B là hai chất phản ứng hoàn toàn (vừa đủ)
+ => Sau phản ứng A còn lại và B đã phản ứng
+ => Sau phản ứng A phản ứng hoàn toàn còn B còn lại
Tính khối lượng các chất theo tổng số chất phản ứng.
Công thức: Số mol (dư) = Tổng số mol ban đầu – tổng số mol đã phản ứng
Lưu ý: Đối với các bài toán liên quan đến cả lượng chất tham gia và lượng chất sản phẩm, việc tính toán sẽ dựa trên lượng chất sản phẩm.
Bài tập tính số mol và nồng độ mol
Ví dụ 1:
Thêm 3,9 gam Kali vào dung dịch HCl dư. Tính thể tích khí hiđro thu được ở điều kiện tiêu chuẩn.
Giải pháp:
Phản ứng xảy ra theo 2 phương trình
2K + 2HCl → 2KCl + H2 ↑ (1)
2K + 2H2O → 2KOH + H2 ↑ (2)
Số mol Kali: nK = 3,9/39 = 0,1 mol
Theo phương trình phản ứng (1) và (2), nH2 = nK = 0,1 mol
Vậy thể tích khí hiđro thu được ở điều kiện tiêu chuẩn là: VH2 = 0,1 x 22,4 = 2,24 lít.
Ví dụ 2:
Tính nồng độ mol của 5 lít dung dịch chứa 0,5 mol NaCl.
Giải pháp:
Độ mol sẽ được tính như sau:
CM = 0,5/5 = 0,1M
Ví dụ 3: Tính nồng độ mol của dung dịch khi hòa tan 15,8g KMnO4 trong 5 lít nước.
Giải pháp:
Số mol của KMnO4 là: nKMnO4 = 15,8/158 =0,1 (mol)
Nồng độ mol của dung dịch: CM = 0,1/5 = 0,02M
Ví dụ 4: Trong 100ml dung dịch có 8 gam NaOH hòa tan. Tính nồng độ mol của dung dịch.
Giải pháp:
Ta có V = 100ml = 0,1 lít
nNaOH = 8/40 = 0,2 mol
Áp dụng công thức trên ta có:
CM = n/V =0,2/0,1= 2M
Ví dụ 4: Tính khối lượng chất tan trong 600ml dung dịch CuSO4 có nồng độ mol 1,5M
Giải pháp:
Ta có V = 500 ml = 0,5 lít
Áp dụng công thức CM = n/V => nCuSO4 = V x CM = 0,5 x 1,2 =0,6 (mol)
Khối lượng đồng sunfat CuSO4: nCuSO4 x MCuSO4 = 0,6 x 160 = 96 (g)
Ví dụ 5: Đốt 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc theo sơ đồ phản ứng sau
P + O2 → P2O5
Câu hỏi: Sau phản ứng, chất nào còn lại và nếu có thì bao nhiêu?
– Phần thưởng:
Bước 1. Tính số mol chất phản ứng.
nP = 6,2 : 31 = 0,2 (mol)
nO2 = 6,72 : 22,4 = 0,3 (mol)
Bước 2. Cân bằng các phương trình hóa học.
4P + 5O2 → 2P2O5
4 5 2
Bước 3. Dựa vào phương trình phản ứng và tốc độ phản ứng, hãy tìm tỉ lệ mol và hệ số phản ứng của hai chất tham gia theo phương trình phản ứng.
nP : 4 = 0,2 : 4 = 0,05
nO2 : 5 = 0,3 : 5 = 0,06
Ta có tỉ lệ phản ứng: nP : 4 < nO2 : 5
=> P phản ứng hoàn toàn, O2 còn lại.
=> Phương trình tính theo số mol P.
=> Phản ứng nO2 = (0,2 x 5): 4 = 0,25 (mol)
=> Số mol O2 dư = 0,3 – 0,25 = 0,05 (mol)
Hy vọng với những thông tin được Labvietchem chia sẻ trên đây các bạn sẽ có câu trả lời cho câu hỏi “Nốt ruồi là gì?” nồng độ mol là gì? Làm thế nào để tính số mol?. Hi vọng các bạn sẽ học được những kiến thức bổ ích nhất để học tập tốt.
XEM THÊM:
Công thức tính phần trăm nồng độ (C%), mol (CM) và bài tập ứng dụng
Cách tính đương lượng và định luật tương đương trong hóa học
Phương trình nhiệt phân KClO3 (Muối kali clorat)
Các tìm kiếm liên quan:
- công thức tính khối lượng hóa học 10
- công thức tính thể tích dung dịch
- công thức tính thể tích dung dịch
- công thức tính phần trăm số mol


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn