Nội dung bài viết
Khái niệm lượng mưa không còn xa lạ với mỗi chúng ta nhưng bạn đã biết cách nhận biết các chất kết tủa cũng như hiểu rõ ứng dụng của chúng chưa? Nếu chưa, hãy theo dõi bài viết dưới đây của Labvietchem để có được câu trả lời chính xác nhé.
1. Tổng quan về kết tủa là gì?
1.1. Kết tủa là gì?
Lượng mưa là hiện tượng hình thành chất rắn từ dung dịch lỏng khi xảy ra phản ứng hóa học trong dung dịch đó. Kết tủa là những chất không tan trong dung dịch sau quá trình phản ứng và tồn tại ở dạng rắn. Nếu không chịu tác dụng của trọng lực để tạo sự liên kết giữa các hạt rắn thì chúng tồn tại trong dung dịch dưới dạng huyền phù.
Sau khi lắng, đặc biệt là khi sử dụng phương pháp ly tâm trong phòng thí nghiệm để nén chúng thành khối, kết tủa có thể được coi là “dạng viên:
Chất lỏng không kết tủa còn lại được gọi là supernatant hoặc supernate, còn bột thu được sau quá trình kết tủa được gọi là floc.

Kết tủa là gì?
1.2. Điều kiện hình thành lượng mưa
Điều kiện để kết tủa là bazơ và axit yếu phản ứng với nhau tạo thành muối không tan. Phản ứng kết tủa là phản ứng hóa học trong đó sản phẩm thu được có chứa chất rắn hoặc kết tủa hòa tan ít.
Phản ứng dừng lại khi có sự cân bằng giữa độ hòa tan và lượng mưa. Điều này có nghĩa là tốc độ kết tủa bằng tốc độ hòa tan.
1.3. Làm thế nào để xác định kết tủa?
- Thực hiện phản ứng hóa học rồi nhận xét: Kết tủa là những chất không tan trong dung dịch sau quá trình phản ứng.
- Sử dụng bảng độ tan có sẵn của một số kết tủa thông dụng
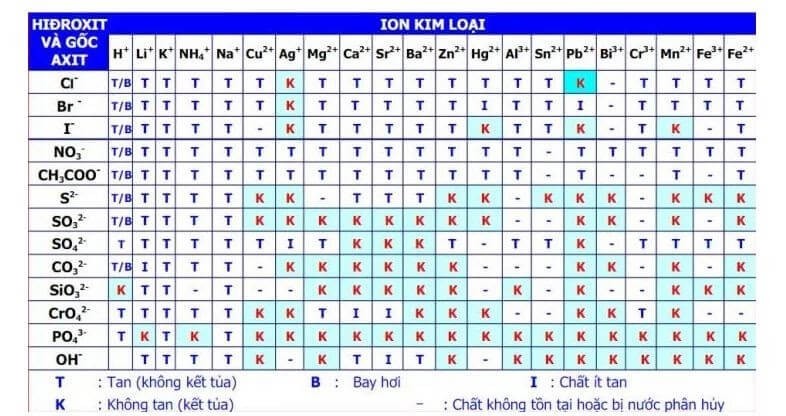
Bảng độ hòa tan có thể được sử dụng để xác định kết tủa
2. Ứng dụng nổi bật của chất keo tụ
- Được sử dụng để loại bỏ muối khỏi nước, cô lập sản phẩm hoặc điều chế chất màu
- Được sử dụng để xác định anion hoặc cation trong muối như một phần của quy trình phân tích định tính
- Làm giảm mạnh độ hòa tan của một số sản phẩm mong muốn. Sau đó nó được tách ra bằng cách ly tâm, lọc hoặc tẩy
- Trong luyện kim: dùng để tạo ra hợp kim có độ bền cao

Ứng dụng chất kết tủa trong xác định anion, cation trong muối
3. Tìm hiểu về các kết tủa thông thường
3.1. Kết tủa thông thường
|
KHÔNG |
Kết tủa |
Màu sắc của kết tủa |
KHÔNG |
Kết tủa |
Màu sắc của kết tủa |
|
1 |
Al(OH)3 |
Keo trắng |
15 |
CaCO3 |
Trắng |
|
2 |
FeS |
Đen |
16 |
AgCl |
Trắng |
|
3 |
Fe(OH)2 |
Màu xanh trắng |
17 |
AgBr |
Màu vàng nhạt |
|
4 |
Fe(OH)3 |
Màu đỏ |
18 |
AgI |
Màu cam hoặc màu vàng đậm |
|
5 |
FeCl2 |
Dung dịch có màu xanh nhạt |
19 |
Ag3PO4 |
Màu vàng |
|
6 |
FeCl3 |
Dung dịch màu vàng nâu |
20 |
Ag2SO4 |
Trắng |
|
7 |
Củ |
Màu đỏ |
21 |
MgCO3 |
Trắng |
|
8 |
Cu(NO3)2 |
Dung dịch màu xanh |
22 |
CuS, Ag2S, FeS, PbS, HgS |
Đen |
|
9 |
CuCl2 |
Các tinh thể có màu nâu và xanh lục trong dung dịch |
23 |
Baso4 |
Trắng |
|
10 |
Fe3O4 (rắn) |
Màu nâu sẫm |
24 |
BaCO3 |
Trắng |
|
11 |
CuSO4 |
Tinh thể khan có màu trắng, tinh thể ngậm nước và dung dịch có màu xanh lam |
25 |
Mg(OH)2 |
Trắng |
|
12 |
Cu2O |
Màu đỏ gạch |
26 |
PbI2 |
Màu vàng tươi |
|
13 |
Cu(OH)2 |
Xanh da trời |
27 |
C6H2Br3OH |
màu trắng ngà |
|
14 |
CuO |
Đen |
28 |
Zn(OH)2 |
Keo trắng |
Ví dụ cụ thể:
- Cho dung dịch AgNO3 vào dung dịch chứa KCl, thu được AgCl có kết tủa màu trắng
AgNO3 + KCl → AgCl + KNO3
- Phản ứng CaCl2 với Na2CO3 thu được kết tủa CaCO3 màu trắng
CaCl2 + Na2CO3 → CaCO3 + 2 NaCl

Một số kết tủa thường gặp
3.2. Kết tủa trắng thường gặp trong hóa học
|
KHÔNG |
chất kết tủa |
đặc trưng |
|
1 |
Al(OH)3 |
|
|
2 |
Zn(OH)2 |
|
|
3 |
AgCl |
|
|
4 |
Ag2SO4 |
|
|
5 |
MgCO3 |
|
|
6 |
BaSO4 |
|
|
7 |
BaCO3 |
|
|
8 |
CaCO3 |
|
|
9 |
Mg(OH)2 |
|

Tìm hiểu về kết tủa trắng trong hóa học
4. Một số phương pháp sử dụng trong lọc kết tủa
4.1. Lọc
- Sau khi đổ dung dịch chứa kết tủa vào bộ lọc, chất lỏng sẽ đi qua bộ lọc và kết tủa sẽ được giữ lại.
- Trong một số trường hợp cần phải lọc lại vì đôi khi chất lỏng đi qua màng lọc vẫn còn sót cặn
4.2. Phương pháp ly tâm
- Dễ dàng thực hiện, nhanh chóng thu được kết tủa
- Với phương pháp này lượng kết tủa phải lớn hơn lượng chất lỏng
- Sản phẩm thu được sau khi tách khỏi chất lỏng có dạng viên
4.3. Phương pháp gạn
- Chất lỏng sẽ được loại bỏ bằng cách đổ dung dịch ra ngoài và kết tủa hỗn hợp
- Đôi khi người ta còn cho thêm dung môi để tách kết tủa
5.Các câu hỏi thường gặp liên quan đến chất kết tủa
5.1. Khối lượng kết tủa được tính như thế nào?
– Khối lượng kết tủa là khối lượng chất rắn thu được từ dung dịch sau quá trình phản ứng, tính theo công thức:
m = nM
– Trong đó:
- m là khối lượng (tính bằng g)
- n là số mol (mol)
- M là khối lượng mol (g/mol)
5.2. Kết tủa có phải là muối hay không?
Câu trả lời là không. Kết tủa được sử dụng để lọc, loại bỏ hoặc thu hồi muối, làm chất màu hoặc để xác định các chất khi thực hiện phân tích định tính.
Trong phản ứng hóa học, kết tủa sẽ được biểu thị bằng mũi tên hướng xuống bên cạnh công thức hóa học.
5.3. “kết tủa lạnh” là gì?
Loại kết tủa này được hình thành trong quá trình làm tan huyết tương tươi đông lạnh ở nhiệt độ 10 độ C hoặc thấp hơn.
5.4. Muối kết tủa là gì?
Đây là những muối không tan được tạo ra bởi bazơ và axit yếu, dễ bị thủy phân trong nước
5.5. Kết tủa keo là gì?
Là chất rắn được tạo thành dưới dạng huyền phù keo, gồm các hạt có đường kính từ 10-7 đến 10-4 cm.
Trên đây là một số thông tin về các chất kết tủa thông dụng, ứng dụng của chúng và cách nhận biết chúng. Hy vọng qua bài viết Labvietchem đã giúp các bạn hiểu rõ hơn về kết tủa. Đừng quên cập nhật labvietchem.com.vn thường xuyên để tìm hiểu thêm những kiến thức hóa học thú vị nhé.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn