Nội dung bài viết
“axetylen” là gì? Đây là chất khí không màu, chủ yếu được sử dụng làm nhiên liệu và tổng hợp các chất khác. Để tìm hiểu rõ hơn về chất này mời các bạn đọc bài viết dưới đây của Labvietchem.
1. Tổng quan về Acetylene là gì?
1.1. “axetylen” là gì? C2H2 là gì?
Acetylene hoặc axetylen là một hợp chất hydrocarbon không bão hòa có công thức hóa học C2H2. Nó là một hydrocacbon và cũng là ankan đơn giản nhất, gồm 2 nguyên tử cacbon kết hợp với 2 nguyên tử hydro.

“axetylen” là gì?
1.2. Công thức cấu tạo
Trong công thức cấu tạo của hợp chất có 3 liên kết giữa 2 nguyên tử C hay còn gọi là liên kết ba. Trong số đó có hai liên kết không ổn định và dễ bị phá vỡ trong các phản ứng hóa học hữu cơ. Đây cũng là yếu tố quyết định tính chất hóa học đặc trưng của khí axetylen.
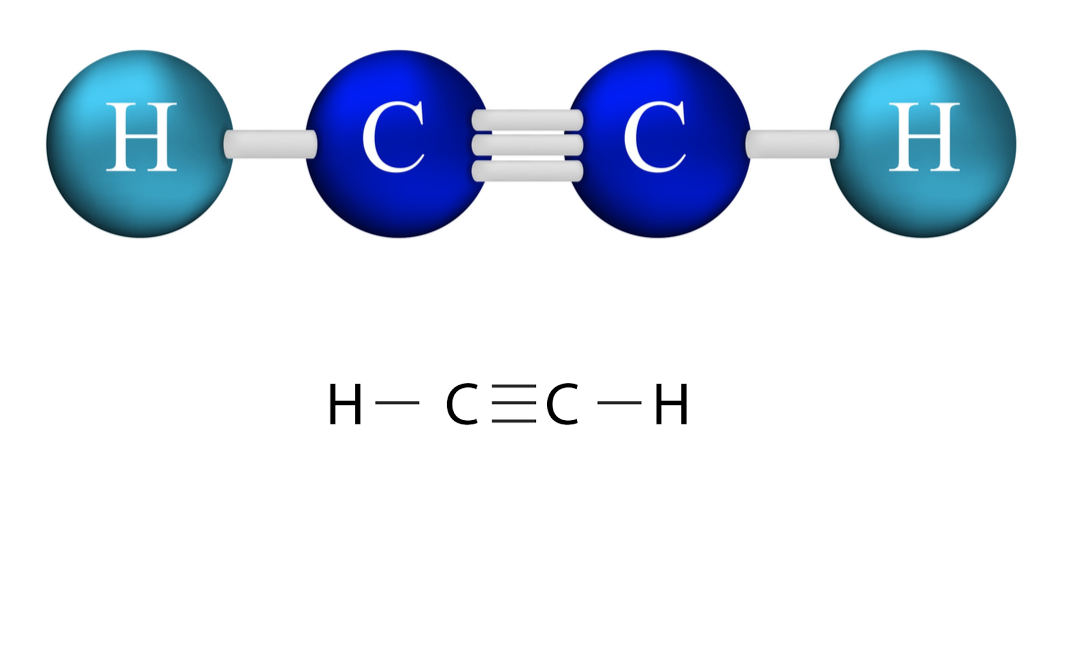
Công thức hóa học của axetylen là C2H2
1.3. Nguồn gốc phát hiện C2H2
Acetylene C2H2 được phát hiện vào năm 1936. Khi đang thí nghiệm kali cacbua trong phòng thí nghiệm, Edmund Davy đã phát hiện ra phản ứng tạo ra một loại khí dễ cháy mà ngày nay được gọi là axetylen.
2. Đặc tính hóa lý nổi bật của Acetylene C2H2
2.1. Tính chất vật lý của C2H2 Axetylen
- Khí không màu và không mùi
- Nhẹ hơn không khí và dễ cháy
- Ít tan trong nước
- C2H2 nguyên chất không có mùi nhưng loại công nghiệp có mùi tỏi vì chứa tạp chất như phosphine và hydrogen sulfide.
- Mật độ: 1.097 kg m-3
- Điểm nóng chảy: – 80,8 độ C
- Điểm sôi: -84 độ C
2.2. Tính chất hóa học của axetylen C2H2
– Phản ứng với oxi
Hiện tượng: xuất hiện ngọn lửa sáng, khói dày đặc, nhiệt độ ngọn lửa rất cao trong quá trình cháy
2C2H2 + 5O2 → 4CO2 + 2H2O
– Acetylen phản ứng với brom (phản ứng cộng)
- Hiện tượng: dung dịch brom mất màu
C2H2 + Br2 → C2H2Br2
- Ngoài ra nó còn tham gia phản ứng cộng với một số chất như H2, Hx,..
C2H2 + Cl2 → C2H2Cl2
C2H2 + 2H2 → C2H6
– Phản ứng với axit
C2H2 + HCl → C2H3Cl
C2H2 + HBr → C2H3Br
C2H2 + HBr → C2H3F
C2H2 + 2HI → C2H4I2
– Phản ứng thay thế kim loại
C2H2 + 2AgNO3 + 2NH3 → 2NH4NO3 + C2Ag2
– Phản ứng axit – bazơ
C2H2 + 2Na → C2Na2 + H2
C2H2 + naNH2 → C2HNa + NH3
C2H2 + CuCl2 + 2NH4OH → 2NH4Cl + Cu2C2 + 2H2O
– Các phản ứng hóa học khác
CH3COOH + C2H2 → CH3COOCHCH2
C2H2 + H2O → CH3COH
3. Điều chế axetylen như thế nào?
- Phương pháp cacbua canxi: Cacbua canxi hoặc đất sét khi kết hợp với nước sẽ tạo ra axetylen
CaC2 + 2H2O → C2H2 + Ca(OH)2
- Phương pháp công nghiệp: nhiệt phân khí metan
2CH4→ C2H2 + 3H2

Những cách phổ biến để điều chế axetylen
4. Công dụng của axetylen là gì?
- Dùng trong chiếu sáng, hàn và cắt kim loại (với ngọn lửa oxy – axetylen)
- Nó là nguyên liệu thô cơ bản để sản xuất các chất như acetaldehyde, axit axetic hoặc benzen, cao su tổng hợp và sợi tổng hợp.
- Với khả năng tạo ra nhiệt độ cao (nhiệt độ của ngọn lửa oxy axetylen có thể đạt tới 3200 độ C), dùng để cắt hoặc hàn kim loại
- Vào cuối những năm 1800, hợp chất này được sử dụng để thắp sáng một loại đèn di động được gọi là đèn khí cacbua. Chúng còn được lắp đặt trên ô tô, xe đạp, trong nhà,… Bên cạnh đó, loại đèn này còn được các thợ mỏ sử dụng rộng rãi khi khai thác mỏ.
- Sản xuất hóa chất: một trong những ứng dụng không thể thiếu của C2H2 là tổng hợp hóa học. Nó được dùng để sản xuất một số hợp chất vô cơ và tổng hợp một số vitamin như vitamin A, E. Ngoài ra, hóa chất này còn được dùng để sản xuất một số thành phần nước hoa, dung môi hoặc axit axetic.
- Nhựa polyetylen, PVDF và PVC được sản xuất từ ethylene hoặc metan, tất cả đều có nguồn gốc từ axetylen.
“axetylen” là gì? Axetylen được dùng để tổng hợp nhiều hợp chất khác
5. Axetylen có nguy hiểm không?
Trong ngưỡng cho phép, hóa chất này sẽ không gây độc cho con người. Theo nghiên cứu, khi tiếp xúc với axetylen C2H2 dưới 2,5% trong thời gian dưới 1 giờ sẽ không có tác dụng. Tuy nhiên, nếu axetylen vượt quá ngưỡng cho phép có thể gây ảnh hưởng tới cơ thể con người như:
- Với nồng độ phơi nhiễm thấp: buồn nôn, đau ngực, choáng váng, khó thở, nhức đầu, da nhợt nhạt, đau phổi, ngạt thở, hôn mê.
- Khi tiếp xúc với da: phát ban
- Do tính chất dễ nổ và dễ cháy nên khi chuẩn bị hoặc bảo quản cần hết sức chú ý đến công tác phòng chống cháy nổ. Chất này khi cháy có thể gây ức chế hệ thần kinh trung ương và khó thở.
6. Những lưu ý khi sử dụng và bảo quản Acetylene
- Luôn trang bị thiết bị an toàn theo quy định khi tiếp xúc và làm việc với axetylen
- Hợp chất này cần được bảo quản ở khu vực riêng, tách biệt với các chất khác, tránh xa những nơi dễ cháy, nguồn lửa, nguồn nhiệt…
- Bảo quản ở nơi khô ráo, thông thoáng, có rào chắn bảo vệ và biển báo cẩn thận.
7. Một số bài tập về Axetylen C2H2

Bài tập về khí axetylen
Bài 1: Tính lượng brom thêm vào C2H2 tối thiểu và tối đa sau khi cho 4,48 lít khí axetylen vào dung dịch Br2
Giải pháp:
PTPU: C2H2 + 2Br2 → C2H2Br4
Lượng Brom thêm vào C2H2 tối đa là: 0,2 x 160 = 32g
PTPU: C2H2 + Br2 → C2H2Br2
Lượng brom thêm vào C2H2 tối thiểu là: 0,1 x 160 =16g
Bài 2: Cho hỗn hợp A gồm C2H2 và H2 có cùng số mol. Khi ta lấy một lượng hỗn hợp Bằng cách đun sôi hỗn hợp B vào dung dịch brom dư thì khối lượng bình brom tăng 10,8 gam và giải phóng ra 4,48 lít hỗn hợp khí C (tại STP) có mật độ hơi so với H2 là 8. Tính thể tích oxy (tại STP) cần để đốt cháy hỗn hợp B.
Giải pháp:
mA (ban đầu) = m tăng sau phản ứng + mA
= 10,8 + 2,8 x 0,2 = 14
Trong khi đó: nC2H2 = nH2 = 0,5
=> Hỗn hợp cháy B sẽ bằng hỗn hợp cháy A
=> nO2 = 1,5 mol
=> VO2 = 33,6l
Hy vọng với bài viết trên Labvietchem đã giúp các bạn hiểu được axetylen là gì, tính chất, cách điều chế và ứng dụng của nó. Đừng quên liên hệ với chúng tôi qua đường dây nóng 0826 020 020 để được giải đáp các vấn đề liên quan hoặc có nhu cầu mua hóa chất, thiết bị thí nghiệm.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn