Nội dung bài viết
Aldehyd là một hợp chất hóa học hữu cơ được sử dụng rộng rãi trong một số ngành công nghiệp như nhựa, dệt nhuộm, dược phẩm,… Tuy nhiên, nó cũng là một chất độc mà người ta vẫn tìm mọi cách để loại bỏ khỏi rượu vang. Vậy aldehyd là gì? Nó có cấu trúc như thế nào? Tính chất hóa học của nó khác với các hydrocacbon khác như thế nào? Hãy cùng LabTrường Lê Hồng Phong tìm hiểu qua bài viết sau đây nhé!
Tổng quan về andehit
1. Aldehit là gì?
Aldehyd là các hợp chất hữu cơ trong đó các phân tử chứa nhóm –OH = O được gắn với các gốc hydrocarbon, với H hoặc liên kết với nhau.
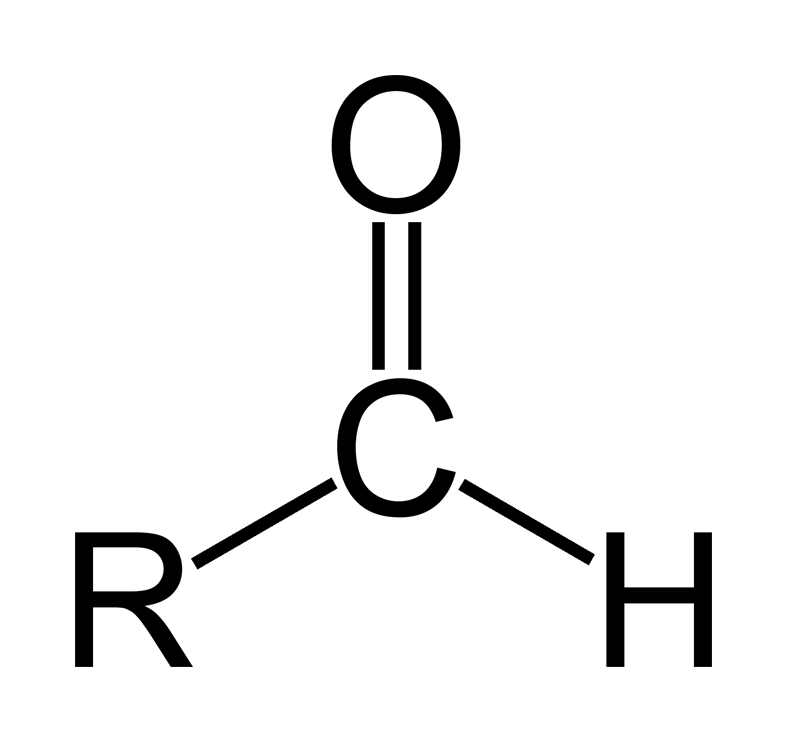
Aldehit là gì?
2. Công thức của aldehyd là gì?
- Aldehyt có công thức tổng quát: R(CHO)m (trong đó m ≥ 1). R có thể là H hoặc gốc hydrocarbon, đặc biệt là hợp chất CHO-CHO, trong đó m = 2 và R không tồn tại.
- Đối với aldehyt bão hòa, đơn chức và mạch thẳng: CnH2n+1CHO (n ≥ 0)
- Trong phân tử của một hợp chất có nhóm chức –OH liên kết với cùng một gốc R, có thể bão hòa hoặc không bão hòa
3. Phân loại aldehyt
– Dựa vào đặc điểm cấu trúc của các gốc hydrocarbon, chúng có thể được chia thành:
- Aldehyd không
- Aldehyt không bão hòa
- Aldehit thơm
– Nếu dựa vào nhóm –CHO ta có:
- Aldehit đơn chức
- Aldehit đa chức năng
4. Cách nhận biết andehit
- Khả năng tạo kết tủa sáng bóng với AgNO3/NH3
- Tạo kết tủa đỏ gạch với Cu(OH)2 ở nhiệt độ cao
- Có thể làm dung dịch nước brom mất màu
(Đặc biệt, khi HCHO phản ứng với dung dịch brom sẽ thoát ra khí CO2)

Tạo kết tủa đỏ gạch với Cu(OH)2 ở nhiệt độ cao
5. Hướng dẫn gọi tên aldehyt
– Với tên thay thế
Tên thay thế = tên hydrocarbon tương ứng + ai
– Tên thông thường
Tên thường gọi = aldehyt + tên axit tương ứng
Lưu ý: Dung dịch HCHO 37 – 40% được gọi là formalin hoặc fomon.
Tính chất cơ bản của aldehyt
1. Tính chất vật lý
1.1. Aldehit là dạng nào?
Aldehyt dạng khí là aldehyd hàng đầu trong điều kiện bình thường và có khả năng hòa tan rất tốt trong nước. Tiếp theo là các aldehyd lỏng hoặc rắn có độ hòa tan giảm khi khối lượng phân tử tăng
1.2. Các tài sản khác:
- Có nhiệt độ sôi thấp hơn rượu tương ứng vì không có liên kết hydro giữa các phân tử aldehyd
- Formalin là dung dịch bão hòa của formaldehyde formic (37 – 40%)
2. Tính chất hóa học của Aldehyt
– Phản ứng cộng hydro
- Phương trình tổng quát: R-CHO + H2 → R-CH2OH (to, Ni)
- CH3-CH=O + H2 → CH3-CH2-OH (đến, Ni)
– Xảy ra phản ứng oxy hóa không hoàn toàn
- PTTTT tổng quát: R-CH=O + 2AgNO3 + 3NH3 + H2O → R-COONH4 + 2Ag + 2NH4NO3 (to)
- HCHO + 2AgNO3 + 3NH3 + H2O → H-COONH4 + 2Ag + 2NH4NO3 (đến)
- Phản ứng này còn được gọi là phản ứng mạ bạc
– Phản ứng với thuốc tím và nước brom
- Hợp chất này rất dễ bị oxy hóa, có khả năng làm mất màu nước brom và dung dịch thuốc tím và bị oxy hóa thành axit cacboxylic:
RCH = O + Br2 + H2O → R-COOH + 2HBr
- Riêng đối với HCHO sẽ xảy ra phản ứng sau:
HCH=O + 2Br2 + H2O → CO2 + 4HBr
Cách điều chế aldehyd

Aldehit được điều chế như thế nào?
– Từ rượu
Quá trình oxy hóa rượu bậc nhất: R-CH2OH + CuO → R-CHO + H2O + Cu
– Từ hiđrocacbon
CH4 + O2 → HCHO + H2O
2CH2=CH2 + O2 → 2CH3-CHO
CH-CH + H2O → CH3-CHO
– Trong công nghiệp
- Sử dụng phương pháp oxy hóa metanol sử dụng oxy không khí ở nhiệt độ 600 – 700 độ C với sự tham gia của chất xúc tác Cu hoặc Ag để điều chế formaldehyde.
2CH3-OH + O2 → 2HCH=O + 2H2O
Ứng dụng của andehit
– Formaldehit:
- Chủ yếu được sử dụng trong sản xuất poly (phenolformaldehyde) – làm chất dẻo và tổng hợp thuốc nhuộm và dược phẩm.
- Dung dịch formaldehyde có nồng độ 37 – 40% trong nước gọi là formalin, chủ yếu dùng để ngâm xác động vật, thuộc da hoặc khử trùng, diệt khuẩn…

Formaldehyde được sử dụng trong tổng hợp thuốc nhuộm
– Acetaldehyde: chủ yếu dùng trong sản xuất axit axetic.
Tìm hiểu thêm về cách lọc aldehyd trong rượu vang
1. Aldehit ảnh hưởng đến sức khỏe con người như thế nào?
- Aldehyd là chất độc có trong rượu, được hình thành do quá trình oxy hóa ethanol. Là nguyên nhân gây sốc, chóng mặt khi uống rượu, ảnh hưởng đến hệ tuần hoàn, hệ tiêu hóa,…
- Aldehyd là nguyên nhân gây chóng mặt, sốc sau khi uống rượu. Sau khi vào cơ thể sẽ gây kích ứng mạnh tới hệ tiêu hóa, tuần hoàn, dẫn đến cao huyết áp, đau đầu.
- Nếu nồng độ của hợp chất vượt quá mức cho phép, chất độc sẽ ảnh hưởng trực tiếp đến não và có thể dẫn đến nhiều biến chứng nguy hiểm.

Aldehyd là chất độc có trong rượu
2. Ngộ độc hàm lượng andehit trong rượu
- Theo tiêu chuẩn Việt Nam 7043 – 3013, hàm lượng andehit trong rượu không được vượt quá 50 mg/lít rượu, tính theo nồng độ cồn của ethanol 100 độ. Ví dụ: 1 lít rượu trắng 40 độ, hàm lượng aldehyd đo được không được vượt quá 20 mg.
- Tuy nhiên, khi làm rượu thủ công, hàm lượng hợp chất thường vượt quá tiêu chuẩn. Vì vậy, trước khi uống rượu, chúng ta nên loại bỏ một phần chúng ra khỏi rượu để có thể uống an toàn hơn.
3. Một số biện pháp giúp lọc aldehyt trong rượu
- Làm nóng rượu: làm bay hơi hợp chất khi đun nóng vì nó có nhiệt độ bay hơi thấp hơn rượu
- Hạ rượu: theo thời gian, các chất độc trong rượu sẽ dần được chuyển hóa khi hạ rượu. Dưới tác dụng của từ trường cũng sẽ làm rượu mềm và thơm hơn. Hãy chắc chắn sử dụng lọ gốm để nghiền rượu
- Sử dụng máy thải độc rượu

Hướng dẫn đơn giản cách loại bỏ aldehyd trong rượu vang
Một số bài tập liên quan đến andehit
Bài tập 1: Một aldehyd là gì? Viết công thức cấu tạo của các aldehyd có công thức phân tử CH4H8O và gọi tên chúng.
Giải pháp:
Aldehyd là các hợp chất hữu cơ trong đó các phân tử chứa nhóm –OH = O được liên kết với các gốc hydrocarbon, với H hoặc với nhau.
CTCT của aldehyd có công thức phân tử C4H8O là: CH3-CH2-CH2-CHO và được gọi là Butanal hoặc 2-methylpropanal
Bài tập 2: Cho 50 gam dung dịch aldehyt axetic vào dung dịch AgNO3 trong lượng NH3 vừa đủ ta thu được 21,6 gam Ag kết tủa. Tính nồng độ phần trăm của aldehyd axetic trong dung dịch đã sử dụng.
Giải pháp:
Chúng tôi có PTPU:
CH3CHO + 2AgNO3 + 3NH3 → CH3COONH4 + 2NH4NO3- + 2Ag
Từ bài viết ta có:
nAg = m: M = 21,6:108 =0,2 mol
Theo PTPU:
nCH3CHO = 1/2nAg = ½ x 0,2 = 0,1 mol
Vậy C%CH3CHO = 8,8%
Bài tập 3: Cho vào ống nghiệm 1,0ml dung dịch formaldehyde 5% và 1,0ml dung dịch NaOH 10%. Sau đó thêm từng giọt dung dịch CuSO4 vào và lắc đều cho đến khi xuất hiện kết tủa. Đun nóng dung dịch trên để thu được kết tủa CuO màu đỏ gạch. Giải thích hiện tượng trên và viết các phương trình phản ứng xảy ra.
Giải pháp:
Nhỏ dung dịch CuSO4 vào ống nghiệm thấy có kết tủa màu xanh:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Đun nóng phần trên của ống nghiệm trên ngọn lửa đèn cồn thu được kết tủa màu đỏ gạch.
HCHO + 4Cu(OH)2 + 2NaOH → Na2CO3 + 2CuO + 6H2O
Bài tập 4:
a) Đốt cháy hoàn toàn 10,8 gam anđehit A thu được 13,44 lít CO2 (điều kiện tiêu chuẩn) và 10,8 gam H2O. Tìm công thức phân tử A.
b) Đốt cháy hoàn toàn anđehit B đơn chức thu được 0,3 mol Co2 và 0,2 mol H2O. MB tốt nhất < 90 đơn vị. Tìm công thức phân tử B.
Giải pháp:
a) nCO2 = nH20 = 0,6 mol => aldehyd bão hòa đơn: CnH2nO
2CnH2nO + (3n – 1)O2 ———-> 2nCO2 + 2nH2O
Ta có tỉ số: (14n+16)/10.8 = n/0.6 => n = 4
Công thức phân tử A: C4H8O hoặc C3H7 – CHO
b) Đặt công thức phân tử B: CxHyO
CxHyO + (x + y/4 – 1/2) O2 ———-> xCO2 + y/2H2O
Ta có tỉ lệ mol: nCO2/nH20 = x/0,5y = 0,3/0,2 => x/y = 3/4
Công thức thực nghiệm (C3H4O)n với M < 90
=> n < 1,6; vậy n = 1.
Công thức phân tử B: C2H3 – CHO.
Bài tập 5: Đốt cháy hoàn toàn 25,4 gam
a) Tìm thể tích khí oxi cần thiết (điều kiện tiêu chuẩn).
b) Xác định công thức phân tử và khối lượng của từng chất trong hỗn hợp X.
Giải pháp:
a) Lập công thức phân tử của rượu bão hòa đơn: CnH2n+2O, x mol và của aldehyt bão hòa đơn: CnH2nO, mol.
phản ứng:
2CnH2n + 2O + (3n’ – 1)O2 ———–> 2nCO2 + 2n’CO2 + 2n’CO2 + 2n’H2O
Số mol CO2: nx + n’y = 26,88/22,4 = 1,2 (a)
Số mol H2O: (n+1)x + n’y = 27/18 = 1,5 (b)
Từ (a) và (b) => x = 0,3
Khối lượng nóng chảy X: (14n + 18)x + (14n’ + 16)y = 25,4
14(nx + n’y) + 18x + 16y = 25,4
14,1,2 + 18,0,3 + 16y => y = 0,2
Số mol O2: 1/2[(3n – 1)x +3n’y] = 1/2[3(nx + n’y) – x] = 1,65 mol
=> VO2 = 22.4.1.65 = 36,96 lít
b) Thay x = 0,3 và y = 0,1 vào (a) ta được: 3n + 2n’ = 12
Chỉ thu được nghiệm n = 2 và n’ = 3. Vậy công thức phân tử của rượu C2H6O (C2H5 – OH) và aldehyd: C3H6O (C€2H5CHO).
Hy vọng bài viết chia sẻ trên của LabTrường Lê Hồng Phong đã giúp các bạn hiểu rõ hơn về aldehyd là gì, những tính chất cơ bản và ứng dụng của nó. Vui lòng liên hệ với chúng tôi qua đường dây nóng 0826 020 020 hoặc nhắn tin cho chúng tôi tại website labvietchem.com.vn nếu bạn vẫn còn thắc mắc.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn