Nội dung bài viết
Amoni NH4 là gì? Đặc điểm, ứng dụng và tác dụng của amoni đối với đời sống sinh học là gì? Đó là thắc mắc của rất nhiều người và để giải đáp những vấn đề này hãy cùng theo dõi bài viết dưới đây của LabvietCHEM nhé.
Amoni NH4 là gì?
– Amoni là cation đa nguyên tử tích điện dương, có công thức hóa học NH4+ được tạo ra do khả năng phóng xạ của amoniac NH3. Trọng lượng phân tử của amoni là 18,04 và được hình thành do tính phóng xạ của amoniac.
– Amoni còn được gọi là amoni hoặc aminoum. Amoni hòa tan dễ dàng trong nước, giúp cân bằng tỷ lệ amoniac trong nước.
Cấu trúc phân tử của NH4
Cặp điện tích tự do trong nitơ amoniac được biểu diễn dưới dạng một cặp điểm. Cặp electron này sẽ tạo thành liên kết với cation hydro H+. Trong ion NH4 +, nguyên tử nitơ tạo thành bốn liên kết cộng hóa trị với hydro, không giống như amoniac có ba liên kết cộng hóa trị có cực. Ion này có cấu trúc tứ diện và không tương tác với metan và borohydrua. Điều này sẽ giúp tạo ra một không gian đồng nhất với phân tử metan, từ đó tạo thuận lợi cho mặt năng lượng. Về kích thước, cation amoni (rionic = 175 chiều) tương tự như cation Caesium (rionic = 183 chiều).
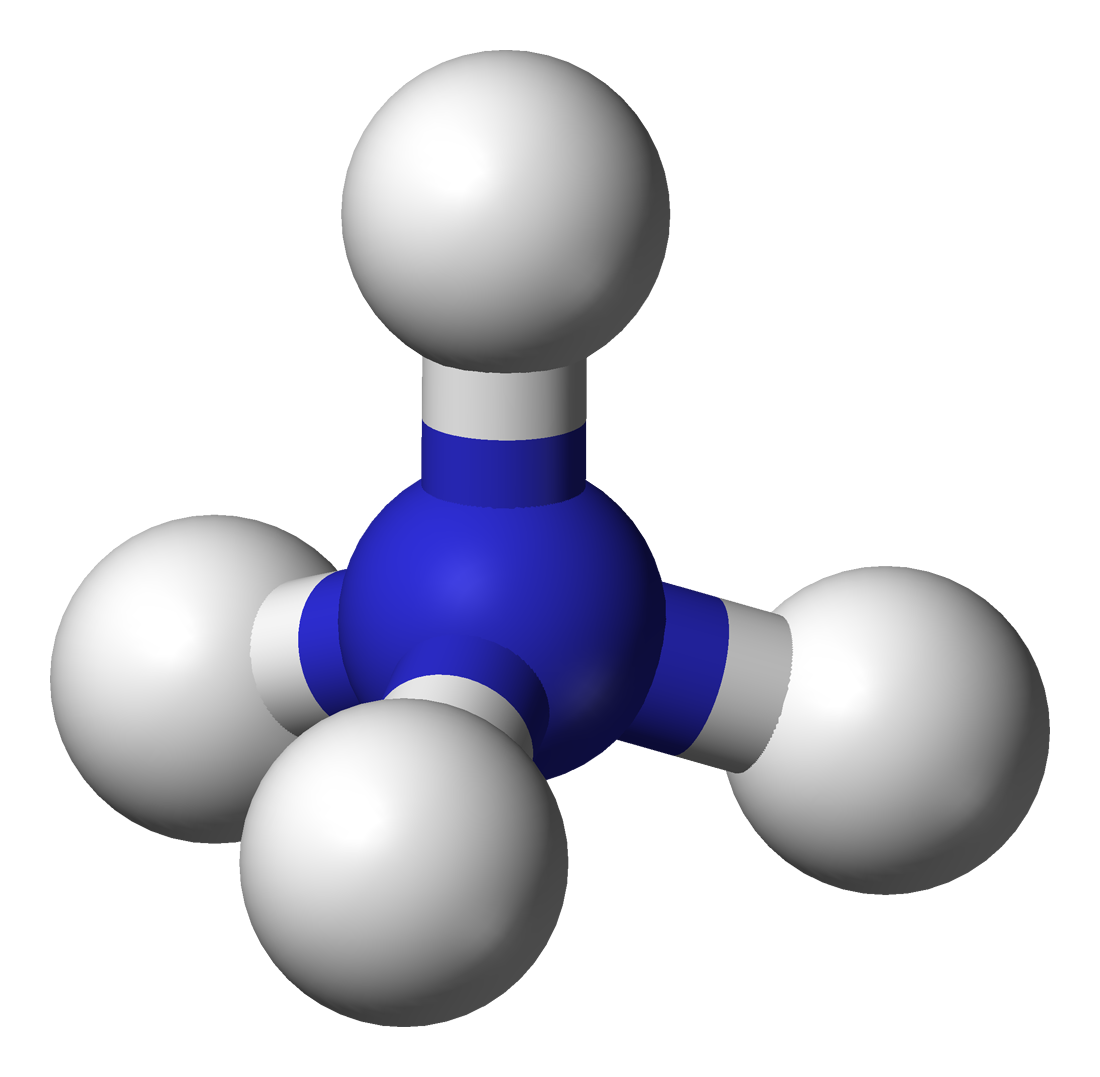
Cấu trúc phân tử của Amoni NH4
Tính chất hóa lý của amoni
1. Tính chất vật lý
– Tất cả các muối amoni đều tan trong nước tạo thành dung dịch không màu và là chất điện li mạnh.
– Amoniac là một bazơ yếu. Nó phản ứng với axit để tạo ra các ion amoni. Khi hòa tan trong nước, một phần nhỏ amoniac sẽ phản ứng với ion hydronium trong nước và tạo ra ion amoni. Ion này là axit liên kết khá mạnh nên có thể phản ứng với hầu hết các bazơ, tái tạo các phân tử amoniac trung tính.
– Trong nước, nồng độ amoniac tạo thành ion amoni phụ thuộc vào độ pH của dung dịch và cả nồng độ amoniac.
(NH4)xA → xNH4 + + Ax-
– Nếu muối amoni của axit mạnh (A là bazơ axit của axit mạnh) thì thủy phân sẽ tạo môi trường axit.
NH4 ++ H2O ↔ NH3↑ + H3O+
2. Tính chất hóa học
– Tác dụng với dung dịch axit tạo thành muối và bazơ mới
NH4 HCO3 + HCl → NH4 Cl + H2O + CO2
– Phản ứng với dung dịch bazơ tạo thành muối, amoniac và nước mới
NH4Cl + NaOH → NH3 + H2O + NaCl
– Tác dụng với dung dịch muối tạo thành 2 muối mới
(NH4)2CO3 + CaCl2 → CaCO3 + 2NH2Cl
– Muối amoni dễ bị nhiệt phân hủy tạo thành amoniac và các axit tương ứng.
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + H2O + CO2
Nếu axit tạo thành sau phản ứng có tính oxy hóa mạnh thì axit đó sẽ tiếp tục oxy hóa NH3 tạo thành sản phẩm khác:
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
Cách nhận biết NH4
– Trong nước, amoni không tồn tại lâu và dễ bị chuyển hóa thành nitrit. Nitrit trong nước sẽ ức chế các enzym trong thịt và cản trở quá trình đổi màu của thịt. Vì vậy, nếu thịt được nấu chín hoàn hảo nhưng vẫn giữ được màu sắc như thịt sống thì nước đã bị nhiễm amoni.
– Ngoài ra, khi nước nhiễm amoni từ 20 mg/l trở lên sẽ ngửi thấy mùi hôi.
– Muối amoni tạo ra khí có mùi hôi khi phản ứng với dung dịch kiềm vì tạo ra khí amoni.
NH4+ + OH- → NH3↑ + H2O
Sự khác biệt giữa NH4+ và NH3
– Các hợp chất amoni dễ dàng được hình thành do bay hơi khi hơi amoniac tiếp xúc với hơi hydro clorua tạo thành đám mây amoni clorua màu trắng, sau đó lắng đọng và tồn tại dưới dạng một lớp mỏng, rắn. Nếu cation amoni bị giảm, khí amoniac và hydro sẽ được giải phóng.
2NH4+ + 2e -> 2NH3 + H2
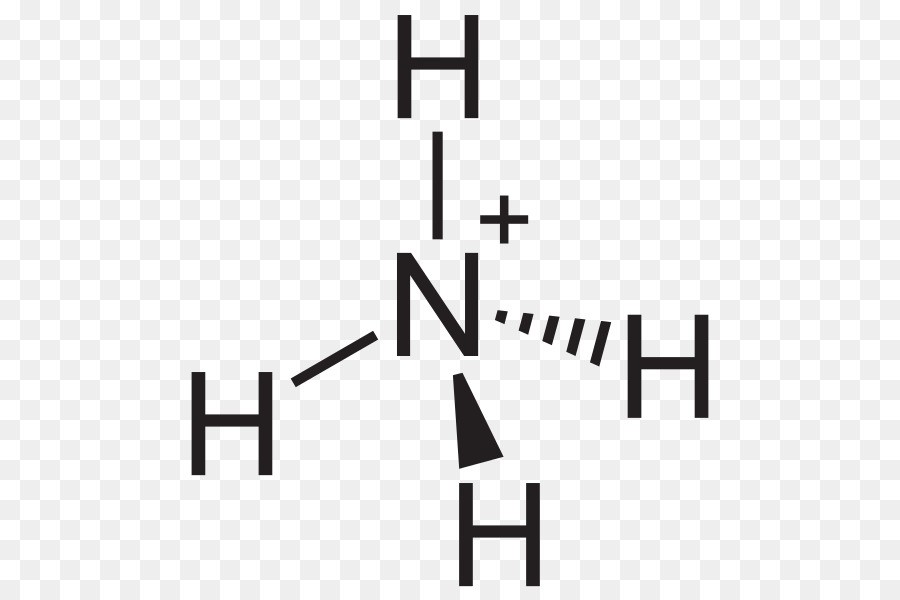
Amoni có bốn liên kết cộng hóa trị
– NH4 và NH3 đều là các dạng vật lý và hóa học khác nhau của nitơ amoni. NH3 tồn tại ở dạng khí không màu. Tuy nhiên, tùy thuộc vào nồng độ amoniac, nó có thể hòa tan trong nhiều vùng nước, tùy thuộc vào nhiệt độ và áp suất. Sau khi hòa tan trong nước, một phần amoniac nhất định sẽ bị phân ly. Nồng độ NH4+ và NH3 hòa tan ở trạng thái cân bằng với độ pH không đổi.
NH4+ ↔ NH3 + H+
Sự khác biệt giữa NH4+ và NH3
NH3 là một dạng amoniac không phân chia, còn gọi là nitơ amoniac tự do, có thể gây độc cho nhiều sinh vật, đặc biệt ở giá trị pH cao vì có thể xuyên qua màng tế bào. Đây là dạng sáp nhập của NH4
NH4 là một dạng amoniac nhất định phân ly trong khi phần còn lại thì không. Nó ít độc hơn NH3 khoảng 300 – 400 lần. Amoni NH4 là dạng amoniac bị ion hóa.
Quy trình xử lý amoni NH4
Ứng dụng của amoni NH4
– Amoni được sử dụng rộng rãi trong các phòng thí nghiệm hóa sinh.
– Là nguồn cung cấp nitơ cần thiết cho cây trồng, đặc biệt khi cây trồng phát triển ở những nơi đất thiếu oxy. Nitơ liên kết với protein trong sinh khối chết, sau đó được vi sinh vật tiêu thụ và chuyển đổi thành ion NH4+ để rễ cây hấp thụ.
– Cung cấp thông tin về lượng axit sản sinh hàng ngày của bệnh nhân thông qua nồng độ amoni trong nước tiểu.
– Amoni hydroxit NH4OH và muối amoni được sử dụng rộng rãi trong chế biến thực phẩm.

Amoni đóng vai trò quan trọng trong việc giúp cây trồng phát triển
Tác động của amoni NH4 đến đời sống sinh vật
– Về bản chất, amoni không độc, tuy nhiên, nếu nguồn nước bị ô nhiễm amoni thì dẫn xuất của nó qua quá trình oxy hóa là nitrit NO2- và nitrat NO3- khá độc. Nitrat gây thiếu hụt vitamin. Nếu kết hợp với amin sẽ tạo ra nitrosamine, là nguyên nhân gây ung thư ở người.
– Ở trẻ sơ sinh, nitrat đặc biệt nguy hiểm. Nếu vào sữa mẹ hoặc sữa pha, khi vào cơ thể, nhờ vi khuẩn trong ruột, nitrat sẽ được chuyển hóa thành nitrit. Đây là chất độc hại gấp nhiều lần nitrat. Khi kết hợp với các amin hoặc alkyl cacbonat sẽ tạo ra các hợp chất nitơ gây ung thư. Ngoài ra, nitrit còn có khả năng oxy hóa sắt II, ngăn cản sự hình thành Hb, làm giảm nồng độ oxy trong máu khiến nạn nhân khó thở, nôn mửa và nếu nồng độ cao có thể dẫn đến tử vong.
– Trong khử trùng nước, amoni sẽ gây lãng phí clo vì amoniac phản ứng với clo làm mất khả năng khử trùng nước. Hơn nữa, các chất độc như chloramine (monocloramine, dichloramine, triclonitrogen) có thể được hình thành.

Amoni làm giảm khả năng khử trùng nước của clo
Mua amoni NH4 ở đâu an toàn, chất lượng tại Hà Nội
Hiện nay trên thị trường không thiếu nhà cung cấp Amoni NH4 khiến khách hàng không biết nên lựa chọn địa chỉ nào đảm bảo cả chất lượng và giá cả. Vì vậy chúng tôi xin giới thiệu đến các bạn công ty Labvietchem.
LabTrường Chu Văn An là đơn vị hàng đầu trong nước về cung cấp các sản phẩm hóa chất phòng thí nghiệm ra thị trường toàn quốc, trong đó có Amoni. Một số sản phẩm hiện có tại Labvietchem
– Amoni sắt sunfat
– Amoni hydro photphat
– Amoni Hydroxit
– Amoni sunfit
– Amoni sắt II Sulfate Hexahydrat
Để được tư vấn thêm về sản phẩm Amoni NH4 và báo giá tốt nhất, vui lòng liên hệ trực tiếp vớiHotline 0826 020 020 hoặc truy cập website labvietchem.com.vn. Sự hài lòng của khách hàng chính là mục tiêu hoạt động và phương châm tồn tại của LabvietCHEM.
Xem thêm:
- Ứng dụng khí amoniac (NH3) trong công nghiệp
- Tác dụng không ngờ của Axit HCl tới đời sống con người


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn