Nội dung bài viết
Chúng ta thường biết các oxit cơ bản trong kiến thức hóa học ở bậc THCS và THPT. Một trong số đó không thể thiếu là oxit bazơ nổi bật natri oxit. Hôm nay chúng ta hãy cùng LabTrường Lê Hồng Phong tìm hiểu về hợp chất này nhé.
1. Khái niệm về natri oxit
Natri oxit là một hợp chất hóa học được sử dụng trong gốm sứ và thủy tinh, mặc dù không ở dạng thô nhưng nó phản ứng với nước tạo thành:
Na2O + H2O -> 2NaOH
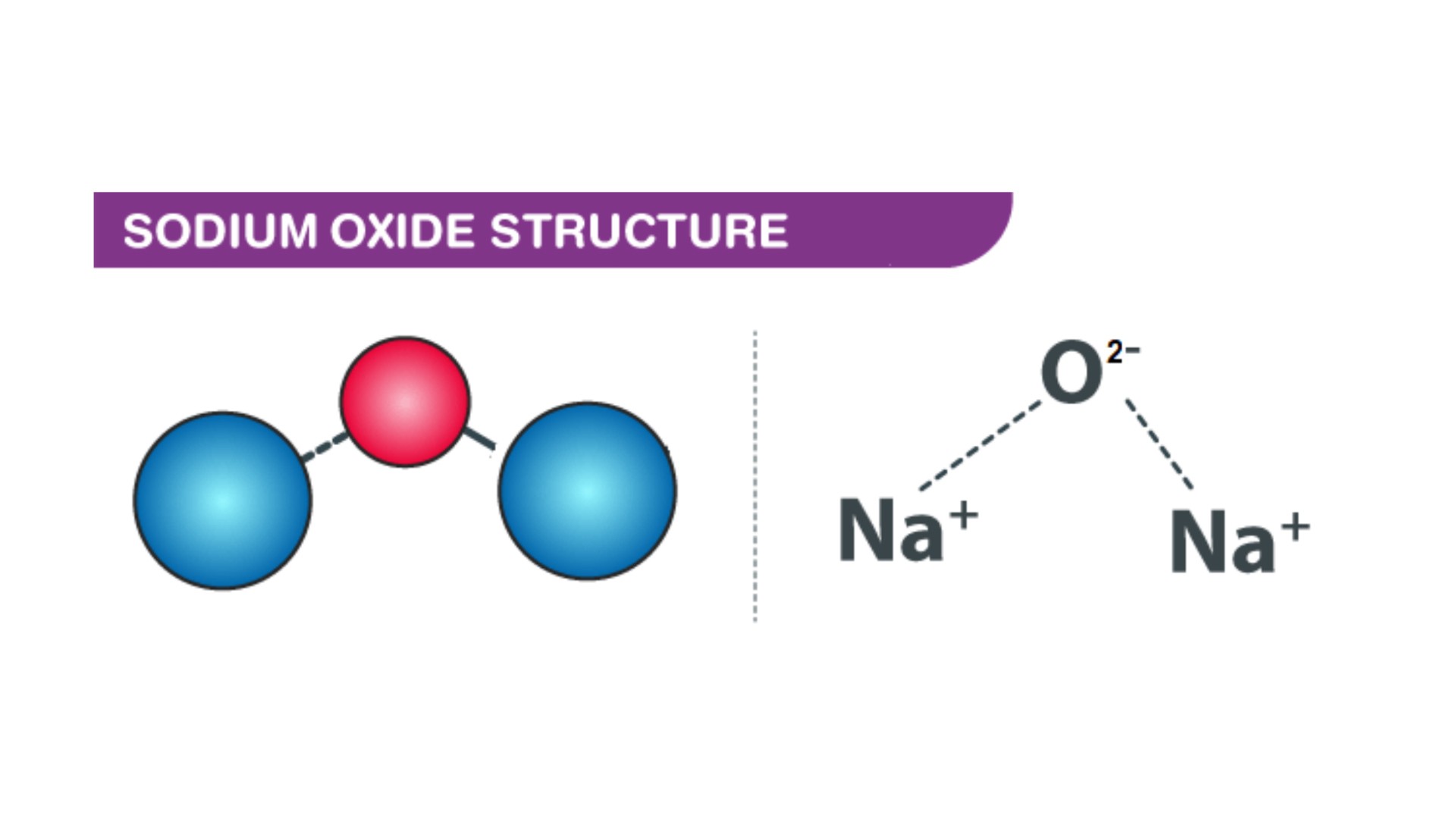
Natri oxit có công thức hóa học Na2O
Các oxit kim loại kiềm đều kết tinh dưới dạng cấu trúc anifluorite. Trong cấu trúc này, vị trí của cation và anion được giữ nguyên như CaF2, trong đó ion natri là tứ diện có 4 ion axit và ion oxit là lập phương có 8 ion natri.
Natri oxit có công thức hóa học Na2O. Khối lượng phân tử 62 g/mol
2. Tính chất vật lý của natri oxit
– Nhiệt độ nóng chảy của Na2O là 1132 độ C, nhiệt độ sôi là 1950 độ C khi nó bắt đầu phân hủy thành natri và natri peroxit kim loại, tuy nhiên một đặc tính thú vị là nó bắt đầu thăng hoa ở nhiệt độ 1100 °C theo Trung tâm thông tin công nghệ sinh hóa quốc gia SF.
– Đây là chất rắn, màu trắng, có cấu trúc tinh thể lập phương.
– Tan tốt trong nước tạo thành dung dịch bazơ. Dung dịch bazơ này sẽ chuyển sang màu tím sang xanh và chuyển phenolphlatein sang màu hồng.
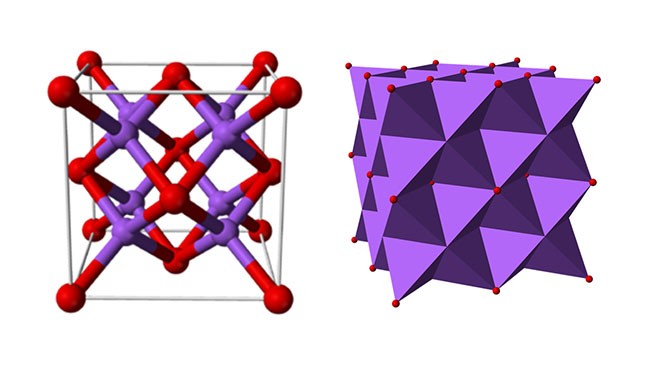
Natri oxit có cấu trúc tinh thể lập phương
3. Natri oxit có tính chất hóa học gì?
Natri oxit là một oxit bazơ nên có đầy đủ tính chất hóa học của một oxit bazơ, phản ứng với nước, phản ứng với oxit axit và phản ứng với axit.
3.1. Natri oxit phản ứng với nước tạo thành dung dịch bazơ
Na2O tan trong nước tạo thành dung dịch trong suốt, không màu, không mùi, không vị. Dung dịch này có tính ăn mòn da và vải nên còn gọi là xút.
Na2O + H2O -> NaOH
3.2. Natri oxit tác dụng với axit oxit tạo thành muối
Trong môi trường bình thường, nó dễ dàng phản ứng với các oxit axit khác để tạo thành hỗn hợp mới gọi là muối:
Với ví dụ phương trình sau:
Na2O + CO2 -> Na2CO3
3.3. Natri oxit tác dụng với dung dịch axit tạo thành muối và giải phóng nước
Phương trình như sau:
Na2O + HCl -> NaCl + H2O
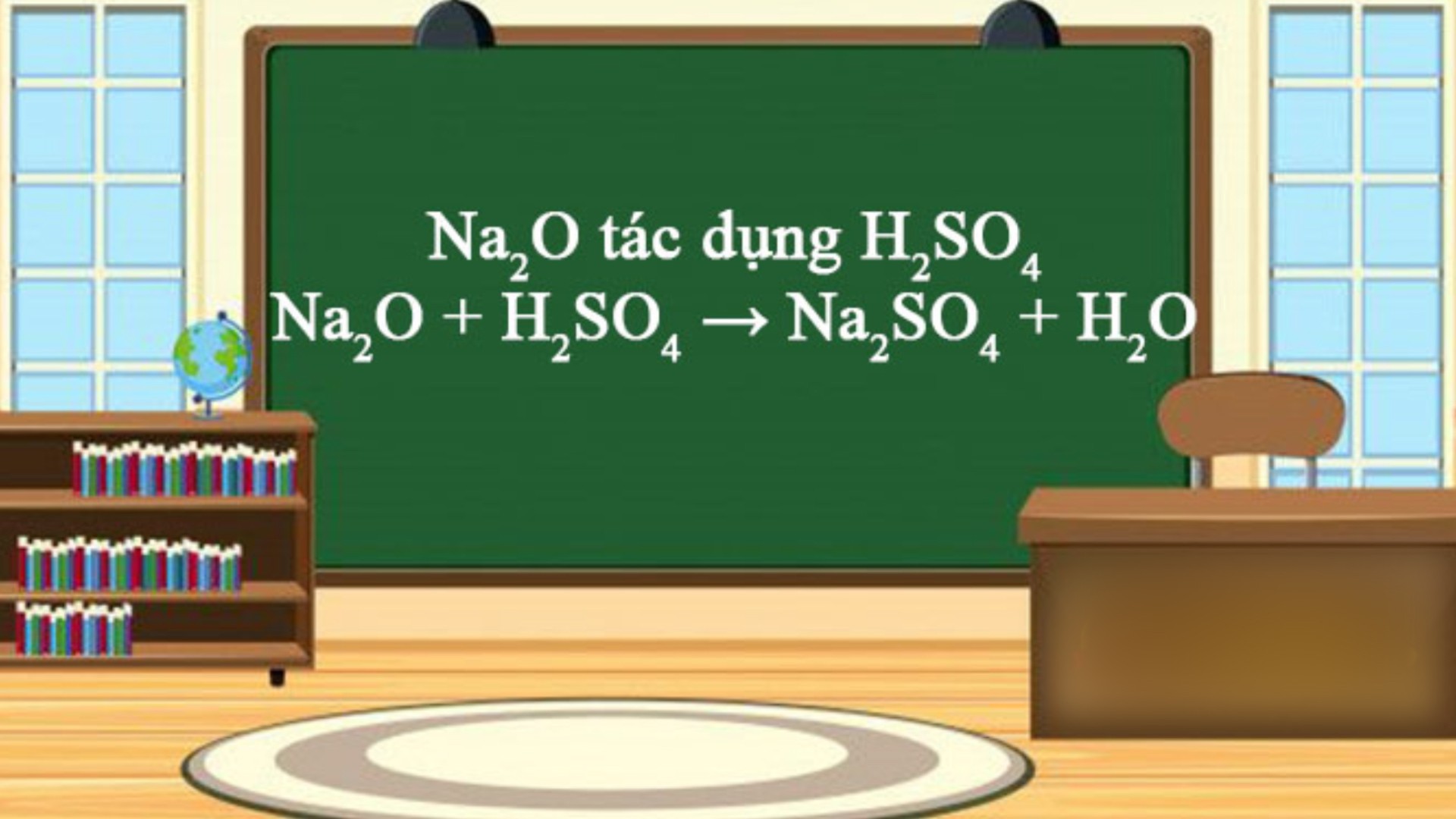
Natri oxit tác dụng với dung dịch axit tạo thành muối và giải phóng nước
3.4. Phản ứng với oxy tạo thành peroxit và superoxit
Natri oxit được tạo ra bằng cách cho natri phản ứng với hydroxit, natri peroxit hoặc natri nitrit
2NaO + 2Na -> 2Na2O + H2
Na2O2 + 2Na -> Na2O
2NaNO2 + 6Na -> 4Na2O + N2
Vì natri trong không khí còn tạo ra Na2O và khoảng 20% natri peroxit Na2O2
4. Ứng dụng natri oxit
– Dùng để chế tạo thủy tinh, làm tấm kính, thông thường thủy tinh sản xuất ra có chứa 15% natri oxit, 70% silic và 9% vôi CaO.
– Natri cacbonat soda đóng vai trò như một hằng số làm giảm tốc độ tan chảy của Silica
– Thủy tinh soda có nhiệt độ nóng chảy thấp hơn nhiều so với thủy tinh nguyên chất và có độ đàn hồi cao hơn. Những biến đổi trên xảy ra do chúng phản ứng với nhau tạo thành công thức chung Na2[SiO2]x[SiO3].
Na2SO3 -> Na2O + CO2
Na2O + SiO2 -> Na2SiO3
– Những phẩm chất này phù hợp để sản xuất nhiều loại sản phẩm thủy tinh bao gồm bóng đèn, ly, chai và các đồ vật nghệ thuật khác.

Thủy tinh lỏng
Mặt khác, natri oxit và silica chứa các tinh thể nước, còn được gọi là natri silicat hoặc thủy tinh, tạo thành chất rắn thủy tinh có đặc tính hòa tan trong nước rất tốt.
– Thủy tinh lỏng được cung cấp dưới dạng cục hoặc bột rắn, hoặc dưới dạng chất lỏng hoặc xi-rô trong suốt. Nó được sử dụng như một nguồn natri thuận lợi cho nhiều sản phẩm công nghiệp như nhà máy sản xuất chất tẩy rửa, chất kết dính và chất kết dính, làm chất keo tụ trong các nhà máy xử lý nước ta cùng nhiều ứng dụng khác.
5. Khả năng phản ứng và sự nguy hiểm của natri oxit
– Là hợp chất không ổn định mà có thể phản ứng mạnh với axit và nước. Tăng quá trình đốt cháy các chất khác và được phân loại là chất ăn mòn có thể gây bỏng da và mắt theo Hiệp hội Khoa học Hoàng gia năm 2015.
– Dung dịch nước là bazơ mạnh nên phản ứng mạnh với axit ăn mòn. Khi phản ứng mạnh với nước, natri hydroxit được tạo ra, chỉ có nước mới tấn công được nhiều kim loại.
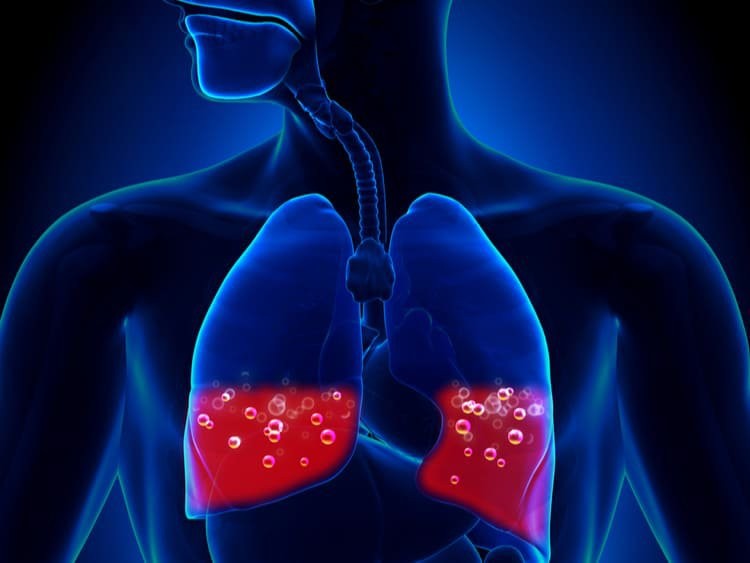
Nếu hít phải natri oxit có thể gây phù phổi
– Chất này còn ăn mòn đường hô hấp khi hít phải và có thể gây phù phổi theo Viện An toàn vệ sinh lao động Quốc gia năm 2014.
– Trường hợp giải thưởng thấp nên chuyển người bị ảnh hưởng đến nơi mát mẻ. Nếu nạn nhân không thở, nên hô hấp nhân tạo. Sau đó hãy gặp bác sĩ càng sớm càng tốt.
– Trong trường hợp tiếp xúc với da, quần áo và giày dép bị nhiễm bẩn phải được cởi bỏ ngay và rửa kỹ bằng nhiều nước.
– Trong trường hợp tiếp xúc với mắt, rửa sạch với nhiều nước ít nhất 15 phút đầu và tham khảo ý kiến bác sĩ. Trong trường hợp bấm nút bên phải, đừng nghĩ đến việc gây nôn mà hãy súc miệng bằng nước và hỏi ý kiến bác sĩ.
– Các triệu chứng và ảnh hưởng quan trọng nhất có thể là kích ứng, sưng tấy, phù nề thanh quản và phế quản gây viêm phổi, phù phổi, cảm giác nóng rát, ho và thở khò khè, phù thanh quản và khó thở.
– Triệu chứng phù phổi thường không xuất hiện ngay mà sau vài giờ và có thể trở nên trầm trọng. Nghỉ ngơi và theo dõi y tế là điều cần thiết.
– Natri oxit nên được bảo quản ở nơi khô ráo, tách biệt khỏi các axit mạnh. Vì hợp chất này phản ứng mạnh với nước nên trong trường hợp hỏa hoạn không được sử dụng bình cứu hỏa hoặc vòi nước. Chỉ nên sử dụng bột khô hoặc cát.
Bài viết trên đã giúp bạn hiểu thêm về natri oxittính chất và ứng dụng của nó. Hãy đóng góp ý kiến của bạn ở phần bình luận và theo dõi các bài viết tiếp theo của LabTrường Lê Hồng Phong nhé.
Xem thêm sản phẩm hóa chất phòng thí nghiệm


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn