Nội dung bài viết
Trong hóa học, halogen là nhóm nguyên tố thường xuất hiện trong các phương trình phản ứng. Vậy halogen là gì? Thuộc tính của nó là gì? Và nó được áp dụng vào cuộc sống như thế nào? Hãy cùng LabTrường Lê Hồng Phong tìm hiểu qua bài viết sau đây nhé!
1. Halogen là gì và cấu trúc phân tử của nhóm Halogen
1.1. Halogen là gì?
Halogen (nhóm nguyên tố Halogen) là các nguyên tố hóa học thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học. Nhóm VIIA này gồm các nguyên tố sau: Flo (F), Clo (Cl), Brom (Br), Iodine (I), Astatine (At – nguyên tố phóng xạ hiếm), Tennessine (Ts – nguyên tố mới được phát hiện). Hai nguyên tố At và Ts là những nguyên tố được coi là nằm ngoài nhóm này nên chúng ta sẽ tập trung tìm hiểu về F, Cl, Br, I.

Halogen là nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học
1.2. Cấu trúc phân tử và cấu hình electron nguyên tử của nhóm halogen
– Các nguyên tố nhóm halogen đều có cấu hình electron là ns2np5 (7 electron ở lớp ngoài cùng, trong đó phân lớp s có 2 electron và phân lớp p có 5 electron).
– Ở trạng thái tự do, 2 nguyên tử của nhóm halogen thường dùng chung một cặp electron tạo nên phân tử có liên kết cộng hóa trị không phân cực vì chỉ thiếu 1 electron ở lớp ngoài cùng sẽ khiến các nguyên tố này đạt được cấu hình electron ổn định giống như khí hiếm.
– Liên kết phân tử (X2) không ổn định nên dễ bị tách thành hai nguyên tử X. Tính chất hóa học cơ bản của nhóm nguyên tố halogen là tính oxi hóa mạnh vì các nguyên tử này dễ dàng nhận thêm electron trong các phản ứng hóa học.
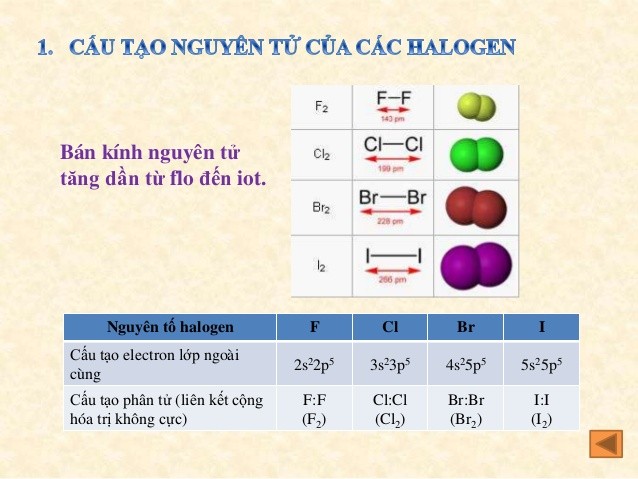
Các nguyên tố nhóm halogen đều có cấu hình electron là ns2np5
2. Nhóm nguyên tố Halogen có tính chất gì?
2.1. Tính chất vật lý
– Trạng thái và màu sắc: Chuyển từ thể khí sang thể lỏng và rắn, cùng với đó màu sắc sẽ dần đậm hơn. F là chất khí, màu xanh nhạt. Cl tồn tại ở dạng khí, màu vàng lục. Br ở dạng lỏng, màu nâu đỏ. I ở trạng thái rắn, màu tím đen, dễ thăng hoa.
– Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần từ F đến I
– Độ hòa tan: F không tan trong nước, Cl, Br, I tương đối khó tan, chỉ tan trong một số ít dung môi hữu cơ.
– Trạng thái tồn tại trong tự nhiên: Tồn tại ở dạng phức hợp. F chủ yếu được tìm thấy trong khoáng vật fluorit và cryolit; Cl tồn tại ở dạng muối clorua; Br được tìm thấy chủ yếu trong các muối bromua của kali, natri và magie, I có mặt trong mô của một số loài rong biển và tuyến giáp của con người.

Tính chất vật lý của halogen
2.2. Tính chất hóa học
– Các nguyên tố thuộc nhóm halogen đều là phi kim điển hình vì có 7 electron ở lớp electron ngoài cùng nên dễ dàng nhận thêm 1 electron để thể hiện tính oxi hóa mạnh.
– Tính oxi hóa của nhóm này sẽ giảm dần từ Flo đến Iốt
– F luôn có mức oxi hóa -1; Cl, Br, I ngoài mức oxi hóa -1 còn có mức +1, +3, +5, +7 trong các hợp chất.
3. Một số phản ứng thể hiện tính chất của nhóm nguyên tố halogen
3.1. Halogen phản ứng với kim loại
– Ngoại trừ Au và Pt, các nguyên tố halogen phản ứng với hầu hết các kim loại (đặc biệt F2 phản ứng với tất cả các kim loại) tạo thành muối halogenua (thường xảy ra ở điều kiện nhiệt độ cao):
2M + nX2 → 2MXn
– Phản ứng với hydro tạo thành hydro halogenua:
H2 + X2 → 2HX
Mỗi halogen có các điều kiện khác nhau để tạo thành phản ứng:
- F2: xảy ra cả trong bóng tối và ánh sáng
- Cl2: chỉ có tác dụng khi được chiếu sáng
- Br2: phải đun nóng ở nhiệt độ cao
- I2: cần đun nóng và phản ứng thuận nghịch
3.2. Phản ứng với nước
– F2 có tác dụng mạnh với nước để giải phóng khí oxi:
2H2O + 2F2 → 4HF + O2
– Br2 và Cl2 phản ứng thuận nghịch với nước:
H2O + Cl2 ↔ HCl + HClO
– Riêng I2 không phản ứng được với nước.
3.3. Phản ứng với dung dịch kiềm
– Đối với dung dịch kiềm loãng lạnh:
X2 + 2NaOH → NaX + NaXO + H2O
(Ví dụ: Cl2 + 2NaOH → NaCl + NaClO + H2O)
Riêng F2 : 2F2 + 2NaOH → 2NaF + H2O + OF2
– Đối với dung dịch kiềm đậm đặc:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
(Ví dụ: 3Cl + 6KOH → 5KCl + KClO3 + 3H2O ở 100 độ C)
3.4. Phản ứng với dung dịch muối halogenua
Phản ứng với dung dịch muối halogenua của nhóm halogen có tính oxi hóa yếu hơn. Riêng F2 không có phản ứng.
X2 + 2NaX’ → 2NaX + X’2
4. Ứng dụng của nhóm nguyên tố Halogen trong đời sống
– Ứng dụng trong sản xuất đèn halogen: Khí halogen đóng vai trò quan trọng trong sự ra đời của bóng đèn halogen. Sự kết hợp của khí halogen (iốt, brom) với dây tóc vonfram tạo ra phản ứng hóa học, bổ sung vonfram vào dây tóc, từ đó tăng tuổi thọ và kéo dài độ trong suốt của vỏ bóng đèn. So với đèn gas thông thường có cùng công suất, bóng đèn halogen có thể hoạt động ở nhiệt độ cao hơn và có hiệu suất chiếu sáng vượt trội.

Ứng dụng trong sản xuất đèn halogen
– Ứng dụng halogen trong ngành điện tử và vật liệu: Các chất và hợp chất không chứa halogen thường được sử dụng làm chất chống cháy và có trong các linh kiện của linh kiện điện tử, vật liệu, nhựa hoặc vỏ sản phẩm. Tuy nhiên, chất chống cháy có chứa halogen thường không thể tái chế được, quá trình đốt cháy sẽ thải ra các chất có hại cho sức khỏe và môi trường.
– Ứng dụng trong y học và: Các nguyên tố nhóm halogen có vai trò rất quan trọng trong y học. Các chế phẩm thuộc nhóm halogen được đưa vào sử dụng có hiệu quả trong y tế:
- Thuốc mỡ iốt được sử dụng để khử trùng vết thương.
- Iodine-123 được sử dụng để chụp ảnh và theo dõi hoạt động của tuyến giáp.
- Iốt–131 đóng vai trò quan trọng trong điều trị ung thư tuyến giáp và bệnh Grave.
- Fluorine là thành phần trong nhiều hợp chất dược phẩm hiện nay như thuốc chống nhiễm trùng. Thuốc chống trầm cảm, thuốc chống viêm khớp…
- Clo và Brom thường được sử dụng để khử trùng bề mặt nước.
- Các nguyên tố halogen là thành phần quan trọng của thuốc vì chúng giúp thuốc thấm vào mô.

Thuốc mỡ iốt được sử dụng để khử trùng vết thương
Trên đây là những thông tin mà LabTrường Chu Văn An cung cấp cho các bạn về halogen và những ứng dụng của nhóm nguyên tố này trong đời sống. Hy vọng nội dung bài viết đã giúp hiểu rõ hơn về nhóm nguyên tố halogen. Nếu có thắc mắc xin vui lòng liên hệ LabTrường Lê Hồng Phong để được giải đáp!
Ngoài ra, nếu bạn đang có nhu cầu về hóa chất, thiết bị phòng thí nghiệm vui lòng tham khảo sản phẩm qua website của LabTrường Chu Văn An hoặc liên hệ số HOTLINE: 0826.020.020 để nhận được hỗ trợ tư vấn. LabTrường Chu Văn An – nhà cung cấp thiết bị phòng thí nghiệm uy tín hàng đầu Việt Nam – rất vinh dự được phục vụ quý khách hàng.
THÔNG TIN LIÊN HỆ LABvietchem:
- Địa chỉ Hà Nội & Các tỉnh phía Bắc: Số 219, Nguyễn Khoai, Hai Bà Trưng, Hà Nội
- Địa chỉ tại khu vực Hồ Chí Minh: Số 43, Đường 19, P. An Phú, TP.Thủ Đức
- Địa chỉ tại khu vực Cần Thơ: Số 55 đường 3/2, P. Hưng Lợi, Q. Ninh Kiều, Cần Thơ
- Đường dây nóng: 0826 020 020
- Email: sales@labvietchem.com.vn
- Website: labvietchem.com.vn


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn