Nội dung bài viết
Kali dicromat hay còn gọi là Kali dicromat tồn tại ở dạng hạt kết tinh màu đỏ cam đặc trưng. K2Cr2O7 tham gia nhiều phản ứng hóa học và được dùng làm thuốc thử trong phòng thí nghiệm. LabTrường Chu Văn An sẽ giới thiệu đến bạn đọc những tính chất của Kali dicromat và những ứng dụng nổi bật của nó trong đời sống qua bài viết dưới đây.
1. Kali dicromat là hóa chất gì?
Kali dicromat là một hợp chất vô cơ, ở dạng hạt kết tinh màu đỏ cam. Nó có công thức hóa học K2Cr2O7 với nhiều tên gọi khác nhau như: Kali dicromat, axit dicromic, muối lưỡng kali,…

K2CrO7 là gì?
Crom trong công thức có số oxi hóa +6, được coi là có hại cho sức khỏe con người. Nó thường được sử dụng trong phòng thí nghiệm và công nghiệp, làm thuốc thử và tổng hợp các chất khác.
2. Tính chất nổi bật của Kali dicromat
2.1. Tính chất vật lý
– Tồn tại dưới dạng chất rắn kết tinh màu đỏ cam.
– Hương vị: Không mùi.
– Khối lượng riêng: 2.676 g/cm3.
– Nhiệt độ nóng chảy: 398 độ C tương ứng với 671 K và 748 độ F.
– Nhiệt độ sôi: 500 độ C tương ứng với 773K và 932 độ F.
– Độ hòa tan:
+ Trong nước: 4,9 g/100 mL ở 0°C, 13 g/100 mL ở 20°C, 102 g/100 mL ở 100°C.
+ Không tan trong rượu và axeton.
– Là chất ăn mòn, có hại cho môi trường và có hại cho sức khỏe.
2.2. Tính chất hóa học
– Tính axit: Làm quỳ tím chuyển sang màu đỏ.
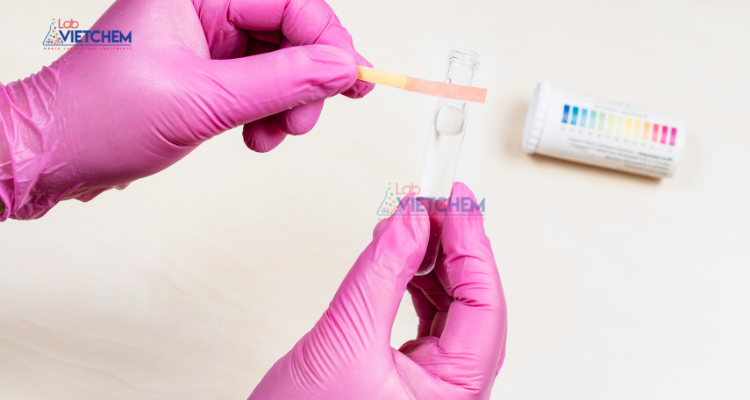
K2Cr2O7 làm quỳ tím chuyển sang màu đỏ tím
– Thể hiện tính oxi hóa mạnh, cụ thể:
+ Trong môi trường axit [H+]Cr+6 bị khử thành Cr+3 theo phương trình sau:
K2Cr2O7 + 6FeSO4 + 7H2SO4→3Fe2(SO4)3 +Cr2(SO4)3 + K2SO4 +7H2O
+ Phản ứng với bazơ: Muối mới tạo thành có màu vàng.
K2CrO7 + KOH => K2CrO4 (vàng) + H2O
+ Khi nung ở nhiệt độ cao khoảng 500 độ C, Kali Dicromat phân hủy thành muối cromat.
4 K2Cr2O7 → 4 K2CrO4 + 2 Cr2O3 + H2O
+ Kali Dicromat tác dụng với các axit như HCL hoặc H2SO4 như sau:
K2Cr2O7 + H2SO4 → Cr2O3+ K2SO4+ H2O
K2Cr2O7 + 14 HCl → 2 CrCl3+ 2 KCl + 3 Cl2+ 7 H2O
Khi cho axit HCl vào dung dịch Kali dicromat thấy xuất hiện bọt khí Cl2 màu vàng lục.
3. Phương pháp tổng hợp Kali dicromat
Nguyên liệu để điều chế K2Cr2O7 là quặng crômit (Fe(CrO2)2). Quy trình sản xuất trải qua 3 công đoạn chính, cụ thể:
– Giai đoạn 1: Dùng O2 để oxy hóa hỗn hợp cromit, soda và đá vôi đã được nghiền mịn. Tiếp theo, cho vào lò nung ở nhiệt độ cao khoảng 1000°C – 1300°C. Ở giai đoạn này sẽ xảy ra phản ứng sau:
4 Fe(CrO2)2+ 8 Na2CO3+ 7 O2 → 8 Na2CrO4+ 2 Fe2O3+ 8 CO2
– Giai đoạn 2: Sản phẩm tạo thành Na2CrO4 được hòa tan trong axit H2SO4 tạo thành muối dicromat.
2 Na2CrO4 + 2 H2SO4 → Na2Cr2O7+ 2 NaHSO4+ H2O
– Giai đoạn 3: Sau khi thu được muối natri dicromat tiến hành phản ứng trao đổi thu được K2Cr2O7.
Na2Cr2O7+ 2 KCl → K2Cr2O7+ 2 NaCl
4. Tầm quan trọng của Kali dicromat trong các lĩnh vực khác nhau
4.1. Trong thí nghiệm
– Là thuốc thử trong hóa phân tích. Dựa vào sự thay đổi màu sắc của chất này sẽ giúp nhận biết, định lượng và phát hiện hợp chất.
– Là nguyên liệu sản xuất phèn crom, crom oxit xanh, crom vàng, crom kali và một số thuốc thử hóa học khác.

Tham gia tổng hợp các hóa chất khác
4.2. Trong công nghiệp
– Là nguyên liệu tổng hợp axit cromic dùng trong điêu khắc thủy tinh.
– Để tăng độ bám dính của xi măng người ta thường bổ sung thêm K2Cr2O7. Ngoài ra, nó còn được sử dụng trong sản xuất và chế biến gỗ.
– Ứng dụng trong công nghiệp phim ảnh, in ấn, sản xuất thuốc nhuộm,…
5. Kali dicromat có tác dụng gì đối với cơ thể?
Kali dicromat có thể gây tác dụng phụ trên cơ thể khi tiếp xúc, hít phải hoặc nuốt phải.
– Tiếp xúc ngoài da: Kích ứng, bỏng da, loét.
– Bắn nước vào mắt: Tổn thương giác mạc, giác mạc bị lồi, đôi khi gây loạn thị.
– Khi hít vào: Gây kích ứng đường hô hấp.
– Vô tình nuốt phải: Trường hợp nhẹ gây bỏng thực quản. Trường hợp nặng hơn có thể gây thủng dạ dày, đau thực quản, buồn nôn, kích ứng và chảy máu đường tiêu hóa, suy hô hấp, tím tái và hôn mê. Nguy hiểm hơn có thể ảnh hưởng tới tính mạng.
– Tiếp xúc lâu dài có thể ảnh hưởng đến hệ tim mạch, tổn thương gan và thần kinh.
6. Những lưu ý khi sử dụng và bảo quản K2Cr2O7
– Cẩn thận không trộn chung với chất khử, chất dễ cháy, chất hữu cơ, kim loại, axit và kiềm vì có thể xảy ra tương tác dẫn đến cháy nổ.
– Vì K2Cr2O7 có tính ăn mòn nên không được bảo quản trong thủy tinh.
– Cẩn thận không để gần gỗ, giấy, nhôm, lưu huỳnh,… vì K2Cr2O7 có thể oxy hóa chúng.
– Khi tiếp xúc với hóa chất phải chuẩn bị đồ bảo hộ như kính mắt, găng tay, áo khoác,… để tránh hóa chất dính vào.
– Bảo quản nơi khô ráo, tránh xa nguồn nhiệt hoặc những nơi có độ ẩm cao.
7. Mua kali dicromat ở đâu giá tốt, uy tín?
Trên thị trường có rất nhiều đơn vị, cơ sở phân phối hóa chất Kali dicromat. LabTrường Chu Văn An cũng là một trong những nhà cung cấp K2Cr2O7 uy tín, được nhiều khách hàng tin tưởng và lựa chọn. Không những vậy, chúng tôi còn có nhiều sản phẩm đa dạng, từ mẫu mã, thương hiệu cho đến giá cả, phù hợp với mọi nhu cầu của khách hàng. Khi lựa chọn tin tưởng Labvietchem, khách hàng không bao giờ phải lo lắng về chất lượng cũng như giá thành sản phẩm. Khách hàng có thể liên hệ với chúng tôi qua đường dây nóng 0826 020 020 hoặc website labvietchem.com.vn để được tư vấn và báo giá chi tiết.
Hy vọng bài viết trên cung cấp những thông tin mà bạn đọc quan tâm về hóa chất kali dicromat.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn