Nội dung bài viết
Clo triflorua hay ClF3 là hợp chất nguy hiểm tồn tại dưới dạng khí không màu hoặc chất lỏng màu xanh lục, có tính oxy hóa mạnh, dễ gây cháy nổ. Với những đặc tính nguy hiểm như vậy, loại hóa chất này có những ứng dụng nào trong đời sống cũng như các phương pháp điều chế, hãy cùng tìm hiểu qua bài viết dưới đây.
1. Tổng quan về clo triflorua
1.1. Clo triflorua – ClF3 là gì?
– Clo triflorua là hợp chất halogen liên hợp, ở dạng khí không màu hoặc chất lỏng màu vàng nhạt hoặc xanh lục.
– Công thức hóa học: ClF3.
– Tên gọi khác: Chloro Trifluoride, Chlor(III) fluoride…
Hóa chất này được sử dụng để làm sạch và khắc axit trong ngành công nghiệp bán dẫn.
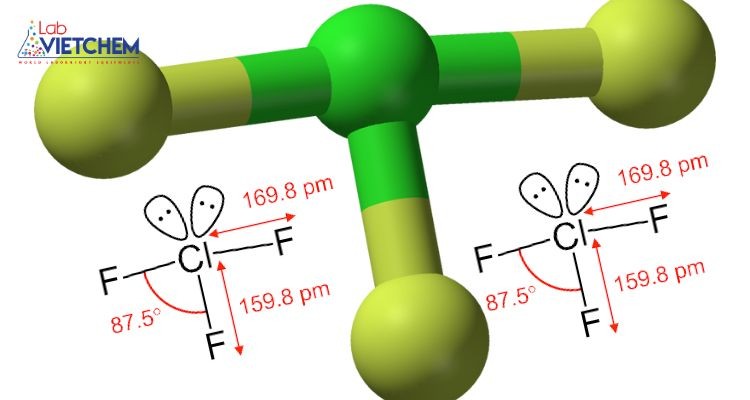
Cấu trúc của hợp chất ClF3
1.2. Kết cấu
ClF3 có hình chữ T với 1 liên kết liên kết và 2 liên kết dài, phù hợp với dự đoán của lý thuyết VSEPR. Liên kết trực tiếp Cl-F dài thích hợp cho liên kết siêu cộng hóa trị.
ClF3 tinh khiết ổn định ở nhiệt độ 180 độ C trong bình thạch anh. Khi vượt quá nhiệt độ này chúng sẽ bị phân hủy theo cơ chế gốc tự do để tạo thành các đơn chất.
2. Tính chất hóa học của clo triflorua
2.1. Tính chất vật lý
– Cảm quan: Tồn tại dưới dạng khí không màu hoặc chất lỏng màu vàng lục nhạt.
– Mùi: Thơm, hăng, khó chịu, ngột ngạt.
– Tỷ trọng: 4 mg/cm3.
– Khối lượng phân tử: 92,4479 g/mol.
– Nhiệt độ nóng chảy: -76,34 độ C tương ứng với 196,81 K hoặc -105,41 độ F.
– Nhiệt độ sôi: 11,75 độ C tương ứng với 284,90K hoặc 53,15 độ F.
– Phân hủy ở 180 độ C tương ứng với 356 độ F hoặc 453 K.
– Phản ứng mạnh với nước và các hợp chất hữu cơ khác như benzen, toluen, ete, axit axetic, hexan,…
– Tạo chất nhạy nổ với CCl4.
– Áp suất hơi: 175 kPa.
– Độ nhớt: 91,82 μPa s.
2.2. Tính chất hóa học
– Phản ứng hóa học xảy ra với một số kim loại tạo ra anion Cl- và F-.
– Tách P khỏi photpho triclorua (PCl3) và photpho pentaflorua (PF5).
– Tách S từ lưu huỳnh điclorua (SCl2) và lưu huỳnh tetraflorua (SF4).
– Phản ứng mạnh với nước, giải phóng khí oxy hoặc oxy Diflorua (OF2), hydro florua (HF) và hydroclorua (HCl). Phương trình phản ứng như sau:. Các oxit kim loại sẽ phản ứng tạo thành muối halogenua kim loại và oxy hoặc oxy Diflorua.
ClF3 + 2H2O → 3HF + HCl + O2
ClF3 + H2O → HF + HCl + OF2
– Phản ứng với oxit kim loại tạo thành muối halogenua kim loại và oxy hoặc oxy diflorua.
– Đây cũng là nguyên liệu chính trong quá trình điều chế urani(VI) florua (UF6). Chất này là một phần của quá trình xử lý và tái xử lý nhiên liệu hạt nhân bằng cách florua hóa kim loại urani:
U + 3ClF3 → UF6 + 3ClF↑
– Trong điều kiện nhiệt độ khoảng 180 độ C, chất này sẽ phân hủy tạo thành ClF và F2.
ClF3 → ClF + F2
3. Phương pháp điều chế Clo triflorua – ClF3
Năm 1930, hai nhà khoa học Ruff và Krug tiến hành fluoride hóa clo nên ClF3 đầu tiên được hình thành. Ngoài ra, phản ứng còn tạo ra ClF, chất này có thể tách khỏi hỗn hợp bằng cách chưng cất.
3F2 + Cl2 → 2ClF3↑
4. Ứng dụng của ClF3 trong nhiều lĩnh vực đời sống
– Dùng làm chất florua và chất chống cháy cho polyme fluorocarbon. Nó được sử dụng để đốt nhiên liệu tên lửa.

ClF3 dùng để đốt nhiên liệu tên lửa
– Công nghiệp bán dẫn: Dùng làm chất tẩy rửa.
– Là hóa chất quan trọng trong quá trình xử lý nhiên liệu hạt nhân để chuyển urani thành urani khí…
– Trước đây trong Thế chiến thứ hai, chất này được sử dụng để làm khí gây cháy nhưng cực kỳ nguy hiểm vì có tính sát thương cao và khó kiểm soát trong quá trình sử dụng.
5. Clo triflorua có nguy hiểm không?
Trong lịch sử có ghi chép rằng Đức Quốc xã từng sản xuất một loại hóa chất cực kỳ khủng khiếp có mật danh là N. Loại vũ khí hóa học này có sức nổ cực cao, phát nổ khi chạm vào nước, có thể gây chết người khi hít phải và phân hủy tạo ra axit độc. Chưa dừng lại ở đó, khi được nạp vào súng phun lửa và bắn ra sẽ tạo ra một quả cầu lửa có nhiệt độ lên tới 2400 độ C nên còn được gọi là ngọn lửa từ địa ngục. Nếu bắt lửa, hóa chất này sẽ cháy dữ dội, thấm vào mọi thứ, kể cả những vật dụng không cháy. Đặc biệt, đám cháy ClF3 rất khó dập tắt.

Ngọn lửa khủng khiếp ClF3
Hợp chất bí ẩn này là Clo triflorua – ClF3
Với đặc tính dễ cháy nổ và có độc tính cao nên hiện nay loại hóa chất này ít được sử dụng. Nếu tiếp xúc với họ, bạn cần phải hết sức cẩn thận.
>> Xem thêm: Danh sách 5 loại hóa chất độc hại khủng khiếp trong lịch sử
Trên đây là toàn bộ thông tin về hóa chất ClF3 cũng như những tính chất đặc trưng của nó. Nếu có bất kỳ thắc mắc hay thắc mắc nào, vui lòng để lại thông tin bên dưới bài viết để đội ngũ chuyên nghiệp của chúng tôi giải đáp. Hãy tiếp tục theo dõi labvietchem.com.vn để theo dõi những bài viết hữu ích khác nhé. Nếu bạn có nhu cầu mua hóa chất, thiết bị hay dụng cụ phòng thí nghiệm hãy liên hệ ngay tới hotline 0826 020 020 để được tư vấn nhanh nhất.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn