Nội dung bài viết
Hydroxit lưỡng tính là một thuật ngữ khá phổ biến trong hóa học nhưng không phải ai cũng hiểu rõ về nó. Vì vậy, nếu bạn muốn tìm hiểu về loại Hydroxide này hãy theo dõi nội dung chia sẻ của LabvietChem dưới đây nhé.
1. Tổng quan về hydroxit lưỡng tính
1.1. Định nghĩa hydroxit
Hydroxit là tên gọi chung của nhóm OH-. Đây là nhóm anion hai nguyên tử, gồm 1 nguyên tử Oxy và 1 nguyên tử Hydro kết hợp với nhau. Sự kết hợp này xuất hiện trong quá trình phân ly của căn cứ, làm cho từ phát sinh. Vì vậy, hầu hết Hydroxide đều có những đặc tính giống như bazơ thông thường.

Hiđroxit là nhóm OH-.
1.2. Lưỡng tính là gì?
Thuyết lưỡng tính được biết đến từ lý thuyết Bronsted và lý thuyết điện di. Bao gồm:
– Là chất có khả năng cho và nhận đồng thời Proton H+ theo lý thuyết Bronsted.
– Là chất có thể phân ly cùng lúc theo hai cách khác nhau: bazơ và axit theo lý thuyết điện phân.
1.3. Hydroxit lưỡng tính là gì?
Hydroxit lưỡng tính có khả năng phân ly thành axit hoặc phân ly thành bazơ khi hòa tan trong nước.
Ví dụ: Zinc Hydroxide (Zn(OH)2) có khả năng phân ly trong nước như sau:
- Khả năng phân ly dưới dạng bazơ: Zn(OH)2 phân ly thành ZnO22- và 2H+
- Khả năng phân ly dưới dạng axit: Zn(OH)2 phân ly thành Zn2+ và 2OH-
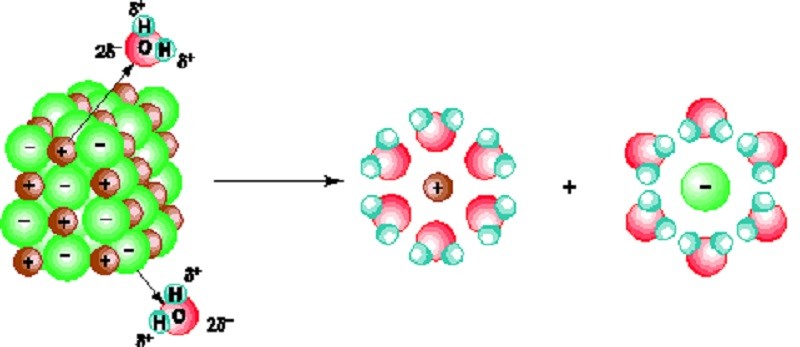
Hiđroxit lưỡng tính tan trong nước và phân ly thành axit và bazơ
2. Chất lưỡng tính là gì?
Một số chất lưỡng tính Hiđroxit lưỡng tính là:
2.1. Nhôm Hydroxit
Nhôm Hydroxit có công thức Al(OH)3. Đây là hợp chất hóa học được tìm thấy nhiều trong tự nhiên nhưng tồn tại dưới dạng khoáng vật gibbsite màu trắng, không tan trong nước.
Al(OH)3 có các tính chất sau:
- Mật độ: 2,42 g/cm3
- Khối lượng mol 78,00 g/ mol
- Độ hòa tan: 0,0001 g/100 ml
- Nhiệt độ nóng chảy: 3000C
- Ổn định với nhiệt, phản ứng với axit mạnh và bazơ mạnh.
Ví dụ:
- Phản ứng với axit: Al(OH)3 + 3HCl → AlCl3 + 3H20
- Phản ứng với bazơ: Al(OH)3 + KOH → 4KAlO3 + 2H2O
2.2. kẽm hydroxit
kẽm hydroxit có công thức hóa học Zn(OH)2. Đây là một hydroxit lưỡng tính có công thức cấu tạo HO – Zn – OH.
Zinc Hydroxide phản ứng với axit, hòa tan trong Amoniac và kiềm. Ngoài ra, Zinc Hydroxide còn phản ứng với các axit hữu cơ và tham gia phản ứng nhiệt phân ở nhiệt độ cao.
Ví dụ:
- Phản ứng với axit sunfuric: Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
- Phản ứng với Natri Hiđroxit: Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
- Phản ứng với Amoniac: Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
- Phản ứng nhiệt phân: Zn(OH)2 → ZnO + H2O (Điều kiện: Nhiệt độ cao)
- Phản ứng với axit hữu cơ: 2CH3COOH + Zn(OH)2 → (CH3CCO)2Zn + 2H2O
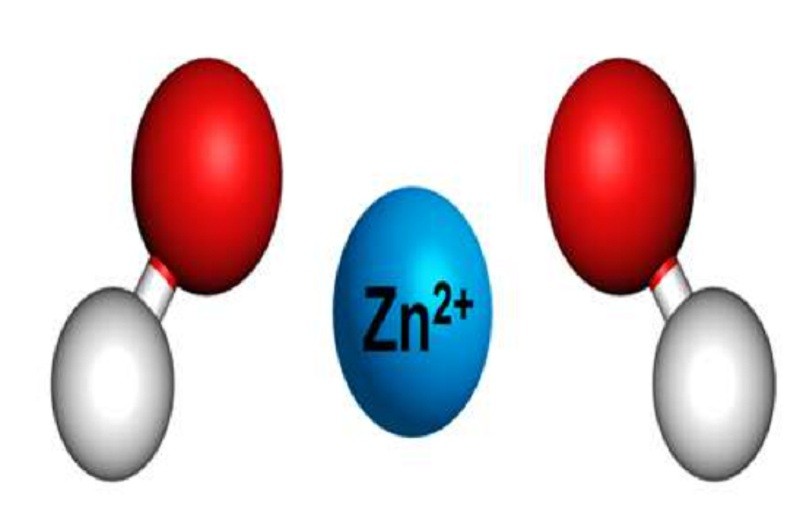
Zn(OH)2 là hiđroxit lưỡng tính
2.3. Chì hiđroxit có tính lưỡng tính?
Chì Hydroxit là chất rắn màu trắng, không tan trong nước. Công thức phân tử là Pb(OH)2 và công thức cấu tạo là HO – Pb – OH.
Chì Hydroxide có thể phản ứng với axit và bazơ nên đây là Hydroxit lưỡng tính.
Ví dụ về các phản ứng như sau:
- Phản ứng với axit: Pb(OH)2 + 2HCl → PbCl2 + 2H2O
- Phản ứng với bazơ: Pb(OH)2 + 2NaOH→ Na2PbO2 + 2H2O
- Dễ bị phân hủy ở nhiệt độ cao: Pb(OH)2 → PbO + H2O (Điều kiện nhiệt độ cao)
3. Phương trình điện phân hydroxit lưỡng tính
Một số phương trình điện phân Hydroxit lưỡng tính:
3.1. Phương trình điện phân của Al(OH)3
Al(OH)3 ⇌ Al3++ 3OH−
Al(OH)3 ⇌ H+ + AlO2− + H2O
3.2. Phương trình điện phân Zn(OH)2
Zn(OH)2 ⇌ Zn2+ + 2OH-
Zn(OH)2 ⇌ 2H+ + ZnO22-
4. Một số câu hỏi thường gặp
Hydroxit lưỡng tính có thể phản ứng với axit và bazơ. Khi nhắc đến chất này, nhiều người vẫn băn khoăn về một số vấn đề liên quan. Dưới đây là câu trả lời để bạn tham khảo:
4.1. Hiđroxit lưỡng tính có tính axit mạnh hay yếu?
Hydroxit lưỡng tính không tan nhiều trong nước. Do đó, tính chất axit và bazơ của chất này yếu. Ví dụ:
Khả năng phân ly yếu của Al(OH)3 như sau:
- Al(OH)3 phân ly như bazơ tạo thành Al2O33- và 3H+
- Al(OH)3 phân ly như axit tạo thành Al3+ và 3OH-
4.2. Mg(OH)2 có phải là hiđroxit lưỡng tính không?
Mg(OH)2 là Bazơ vì khi tan trong nước chất này chỉ phân ly thành Bazơ. Vì vậy, Mg(OH)2 là Chất không lưỡng tính.
Phương trình phân ly như sau: Mg(OH)2 ⇌ Mg2+ + 2OH-
5. Bài tập về Hydroxit lưỡng tính
Chúng ta hãy xem một số trong số họ Bài tập Hydroxit lưỡng tính sau đây:

Một số hydroxit
Bài tập 1: Trong các câu sau, chất nào là hiđroxit lưỡng tính?
- Zn(OH)2
- Mg(OH)2
- Fe(OH)2
- NaOH
Trả lời: Đáp án đúng là A. Zn(OH)2
Bài 2: Trong các ion sau, dãy nào có tính chất lưỡng tính?
- ZnO; Al2O3; H20
- Cl-; Na+; NH4+; H20
- NH4+; Cl-; H2O
- Cl-; Na+
Trả lời: Đáp án A đúng. Cả ZnO; Al2O3 và H20 đều là những chất có khả năng phân ly theo axit và bazơ.
Câu 3: Chất nào sau đây là hiđroxit lưỡng tính?
- Al(OH)3, Cr(OH)2
- Sn(OH)2, Pb(OH)2
- Zn(OH)2
- Cả 3 đáp án trên đều đúng
Đáp án: Đáp án đúng là D
Hydroxit lưỡng tính là chất có khả năng phân ly vừa là axit vừa là bazơ. Nếu bạn muốn tìm hiểu thêm về Hydroxide lưỡng tính hoặc các hóa chất khác, vui lòng liên hệ với Labvietchem theo số hotline: 0826 020 020 để được tư vấn và giải đáp chi tiết.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn