Nội dung bài viết
Trong công nghiệp, khí Lưu huỳnh – SO2 có thể được ứng dụng vào nhiều lĩnh vực khác nhau. Tuy nhiên, đối với hệ sinh thái cũng như sức khỏe con người, loại khí này có thể gây ra nhiều tác động tiêu cực. Hãy cùng LabvietChem tìm hiểu những thông tin sơ bộ về đặc tính lý hóa cũng như ứng dụng của Lưu huỳnh nhé.
1. Khí Lưu Huỳnh – SO2 là gì?
SO2 là gì?? SO2 là khí được tạo ra sau khi đốt lưu huỳnh có trong nhiên liệu hóa thạch hoặc quặng. Tên gọi khác của khí SO2 là Sulfur dioxide, Sulfur dioxide, Khí lưu huỳnh.
SO2 còn được gọi là Sulphur Dioxide
2. Công thức cấu tạo của SO2
Trong phân tử SO2 tồn tại 1 liên kết đôi S=O và 1 liên kết đơn SO. Vì thế, Công thức cấu tạo của SO2 như sau:
O=SO hoặc OS=O
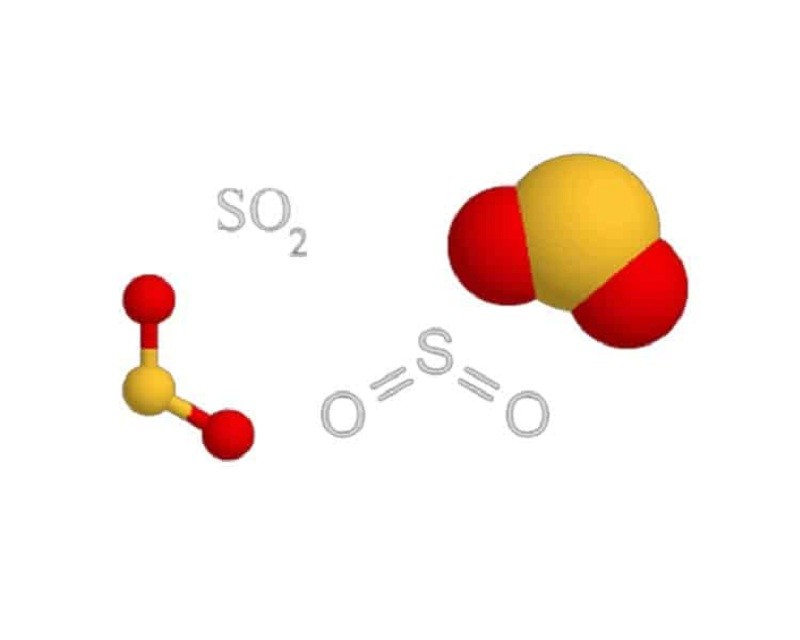
Công thức cấu tạo của SO2
3. Tính chất đặc trưng của SO2
Khí SO2 có những tính chất điển hình sau:
3.1. Tính chất vật lý
SO2 là chất khí vô cơ độc hại, không màu, nặng hơn không khí. Các đặc tính cơ bản của SO2 là làm đục nước vôi trong, làm mất màu cánh hoa hồng và dung dịch brom.
Khối lượng phân tử của SO2 là 64 amu, trọng lượng riêng là 2,551 g/l. Nhiệt độ nóng chảy đạt -72 độ C, nhiệt độ sôi đạt -10 độ C.
Vì vậy, xét về mặt cảm quan, khí SO2 có mùi hăng đặc trưng rất khó chịu. Đồng thời khả năng hòa tan trong nước của hợp chất này cũng rất tốt.
3.2. Tính chất hóa học
Về tính chất hóa học, SO2 có đầy đủ đặc tính của một oxit axit, vừa có thể đóng vai trò là chất khử, vừa có thể đóng vai trò là chất oxy hóa. Cụ thể như sau:
- Có khả năng phản ứng với H2O tạo dung dịch axit
SO2 + H2O → H2SO3
- Có khả năng phản ứng với oxit bazơ tạo muối
SO2 + Na2O → Na2SO3
- Có khả năng phản ứng với các dung dịch bazơ tạo thành muối sunfua hoặc muối hydroxit và H2O
SO2 + 2NaOH → Na2SO3 + H2O
4. Phương pháp điều chế/tổng hợp khí SO2
Khí SO2 được tạo ra trong quá trình đốt hóa thạch và quặng. Vì vậy, khi núi lửa phun trào, lượng SO2 thải vào không khí có thể lên tới hàng triệu tấn.
Tuy nhiên, trong thực nghiệm và thực tế đời sống sản xuất công nghiệp, công việc điều chế SO2 có thể được thực hiện bằng các phương pháp sau:
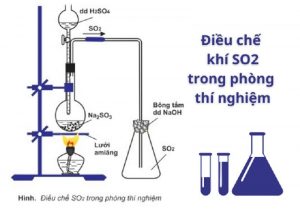
4.1. Điều chế SO2 trong phòng thí nghiệm
Quá trình phản ứng hóa học giữa H2SO4 và axit sunfuric Na2SO3 tạo ra SO2 là phương pháp điều chế khí SO2 dùng trong phòng thí nghiệm. Phương trình hóa học của phản ứng như sau:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
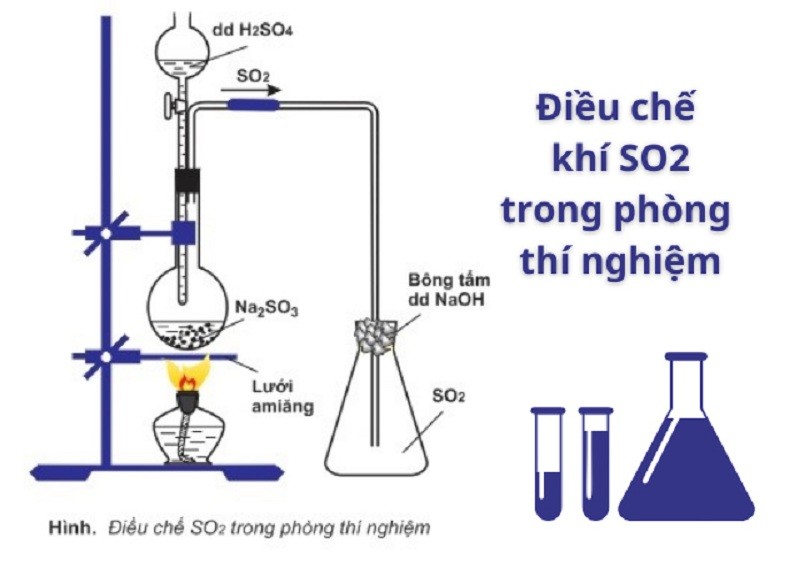
Điều chế SO2 trong phòng thí nghiệm
4.2. Điều chế SO2 trong công nghiệp
Có 2 cách để thu được khí SO2 cho công nghiệp như sau:
Đốt lưu huỳnh: S + O2 (t°) → SO2
Đối với quặng sắt pyrit: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
5. Ứng dụng khí SO2
Trong cuộc sống, Ứng dụng của SO2 rất đa dạng, có thể kể đến như:
- Là chất trung gian để tạo ra H2SO4.
- Làm hóa chất tẩy trắng giấy, bột mì…
- Là chất bảo quản cho nông sản khô.
- Hỗ trợ xử lý nước thải công nghiệp cũng như nước thải sinh hoạt.
- Chất chống oxy hóa, kháng khuẩn phát sinh trong quá trình sản xuất rượu vang.
- Là chất làm lạnh hoạt động trong quá trình làm lạnh công nghiệp.

SO2 có ứng dụng làm chất bảo quản trái cây sấy khô
6. Khí lưu huỳnh – SO2 có độc không?
Về bản chất, khí SO2 rất độc. Đối với cả con người và môi trường sinh thái, sự tồn tại của SO2 nếu vượt quá nồng độ cho phép có thể dẫn tới nhiều tác hại khó lường.
6.1. Đối với con người
Khi con người tiếp xúc trực tiếp với khí SO2, hít phải loại khí độc này vào cơ thể sẽ gây ra những triệu chứng khó chịu. Ví dụ như nóng rát ở mũi họng, tức ngực, khó thở, chóng mặt, mệt mỏi…
Nếu không thể tránh xa nguồn khí SO2 ngay lập tức và kịp thời thực hiện các biện pháp hỗ trợ y tế thì nguy cơ mắc các bệnh về đường hô hấp là rất cao. Trong đó có các bệnh nhiễm trùng đường hô hấp, viêm phổi… Trong nhiều trường hợp, thậm chí người ta còn xác định khí SO2 là nguyên nhân gây viêm mắt nghiêm trọng ở người.
Không những vậy, khí SO2 khi kết hợp với nước và oxy sẽ tạo thành axit sunfuric – một loại axit mạnh rất độc. Chất này nếu vô tình xâm nhập vào cơ thể con người sẽ gây ra nhiều hậu quả nguy hiểm. Ví dụ, nó ảnh hưởng đến lượng kiềm dự trữ trong máu, cản trở quá trình chuyển hóa đường và protein của cơ thể. Từ đó gây tắc nghẽn mạch máu và nhiều bệnh khác.
6.2. Đối với môi trường
Đối với môi trường sinh thái, khí SO2 cũng là một mối nguy hiểm không nhỏ. Nếu hiện diện ở nồng độ cao, dư lượng lớn có thể gây ra nhiều tình huống bất lợi. Ví dụ, mưa axit khiến kết cấu thép bị ăn mòn, cây cối, hoa màu bị phá hủy…
7. Xử lý khí SO2 như thế nào? Lưu ý khi sử dụng và bảo quản
Việc xử lý khí SO2 là cần thiết để đảm bảo tốt nhất sức khỏe con người và sự phát triển bình thường của hệ sinh thái. Một số phương pháp xử lý SO2 hiệu quả hiện đang được áp dụng bao gồm:
- Sử dụng vôi nung (CaO) hoặc đá vôi (CaCO3).
- Sử dụng Oxit kẽm (ZnO).
- Dùng nước để hấp thụ.
- Sử dụng các hợp chất hấp thụ hữu cơ.
- Sử dụng Amoniac.
- Sử dụng các hợp chất hấp phụ rắn.
Tuy có hại nhưng do ứng dụng của khí SO2 không hề nhỏ nên việc con người tiếp xúc và sử dụng loại khí này là cần thiết. Tuy nhiên, để đảm bảo an toàn, cần đặc biệt lưu ý trong quá trình sử dụng và bảo quản khí SO2. Luôn tuân thủ những nguyên tắc chung khi sử dụng khí SO2 để đạt được kết quả khả quan nhất.
Trên đây LabvietChem vừa chia sẻ đến các bạn một số thông tin cơ bản về tính chất lý hóa cũng như ứng dụng của khí SO2. Hy vọng bài viết này hữu ích cho những bạn đang muốn tìm hiểu về loại hợp chất này. Nếu cần hỗ trợ thêm, vui lòng liên hệ ngay với LabvietChem qua số hottline 0826.020.020!



Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn