Nội dung bài viết
Trong cuộc sống, clo là chất được sử dụng phổ biến với nhiều ứng dụng trong đời sống. Ngoài ra, các hợp chất clo như bari clorua còn đóng vai trò cực kỳ quan trọng trong cuộc sống mà bạn chưa biết. Vì vậy, hãy tiếp tục đọc bài viết dưới đây để tìm hiểu thêm về BaCl2 và các tính chất của nó.
1. Khái niệm BaCl2 là chất gì?
BaCl2 còn được gọi là Bari Clorua hay Bari Clorua, là công thức hóa học của một hợp chất vô cơ. Đây là một trong những muối hòa tan trong nước phổ biến nhất của bari.
BaCl2 là công thức phân tử của Bari Clorua và có công thức cấu tạo sau: Cl-Ba-Cl.
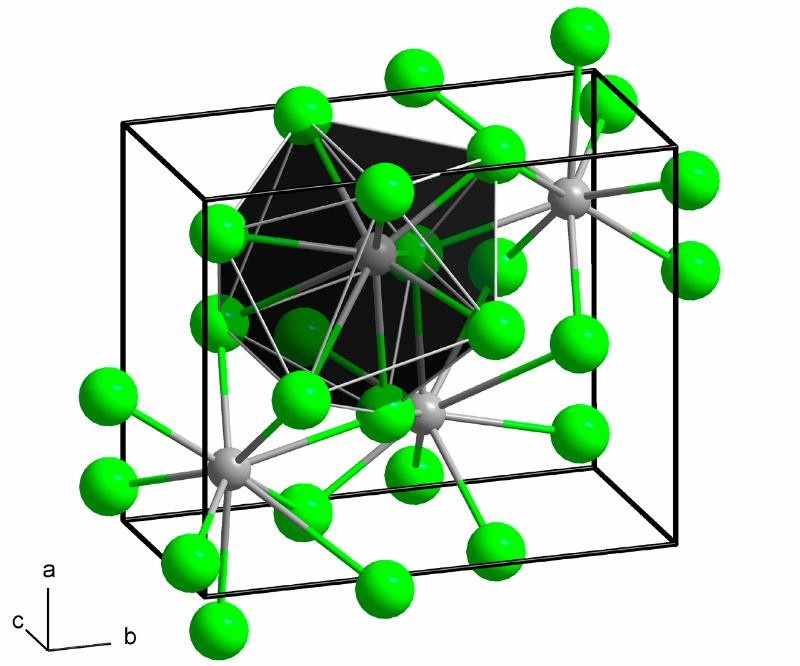
Hình 1: Cấu trúc của BaCl2 – Bari Clorua
2. Tính chất của bari clorua
2.1. Tính chất vật lý
Muối BaCl2 có những tính chất điển hình như sau:
– Đây là chất rắn tan tốt trong nước, có màu trắng.
– Khi đốt sẽ xuất hiện ngọn lửa màu xanh sáng.
– Trọng lượng phân tử:
+ Dạng khan: 208,23 g/mol.
+ Dạng dihydrat: 244,26 g/mol.
– Khối lượng riêng:
+ Dạng khan: 3,856 g/cm³
+ Dạng nước dihydrat: 3,0979 g/cm³
– Nhiệt độ nóng chảy: 962°C tương ứng với 1.235 K hoặc 1.764°F.
– Nhiệt độ sôi: 1.560°C tương ứng với 1.830 K hoặc 2.840°F.
– Độ hòa tan:
+ Trong nước ở nhiệt độ 20 độ C là 35,8 g/100 mL.
+ Hòa tan trong metanol.
+ Không tan trong etanol và etyl axetat.
– Chất này được coi là độc hại và có hại.
Nếu thắc mắc BaCl2 có kết tủa không thì câu trả lời là sẽ tạo ra kết tủa trắng BaSO4 khi phản ứng với axit H2SO4 và muối sunfat.
Để nhận biết muối BaCl2, người ta dùng phương pháp sau: Cho vài giọt H2SO4 vào dung dịch BaCl2, chúng ta sẽ thấy chúng tan trong axit và xuất hiện kết tủa màu trắng. BaCl2 + H2SO4 → 2HCl + BaSO4.

Hình 2: Bột BaCl2
2.2. Tính chất hóa học
BaCl2 thể hiện tính chất đặc trưng của muối, gốm phản ứng với muối hoặc axit. Trong đó sản phẩm tạo thành có chứa ít nhất 1 kết tủa hoặc axit yếu.
– Tạo kết tủa trắng khi phản ứng với axit sunfuric: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
– Tạo kết tủa trắng khi phản ứng với natri sunfat: BaCl2 + Na2SO4 → BaSO4↓ (trắng) + 2NaCl
– Tạo kết tủa trắng khi phản ứng với natri cacbonat: Na2CO3 + BaCl2 → BaCO3↓(trắng) + 2NaCl
– Tạo kết tủa trắng khi tham gia phản ứng trao đổi với bạc nitrat: BaCl2 + 2AgNO3 → 2AgCl↓ + Ba(NO3)2
– Tạo kết tủa trắng khi phản ứng với natri hydro cacbonat: 2NaHCO3 + BaCl2 → 2NaCl + CO2 + BaCO3↓ + H2O
– Tạo kết tủa trắng khi phản ứng với natri bisulfit: BaCl2 + K2SO4 → BaSO4↓ + 2KCl
– Tạo kết tủa màu trắng đục khi phản ứng với natri hydroxit: BaCl2 + 2NaOH → Ba(OH)2↓ + 2NaCl
– Thu được khí H2 ở cực âm và bari clorua ở cực dương khi điện phân dung dịch bari clorua: BaCl2 + 6H2O → Ba(ClO3)2 + 6H2↑
– Tạo kết tủa trắng khi phản ứng với đồng sunfat: BaCl2 + CuSO4 → BaSO4↓ + CuCl2
– Tạo kết tủa trắng khi phản ứng với kali bisulfat: BaCl2 + 2KHSO4 → BaSO4↓ + 2HCl + K2SO4
3. Làm thế nào để điều chế bari clorua?
Người ta sản xuất và tạo ra số lượng lớn BaCl2 dựa trên quá trình điều chế từ bari cacbonat và bari hydroxit có trong tự nhiên gọi là witherit.
Để tạo ra bari clorua ngậm nước, các muối cơ bản trên phản ứng với axit clohydric. Chất này được sản xuất thông qua quy trình hai bước từ khoáng chất bari (bari sunfat) ở quy mô công nghiệp.
– Bước 1 yêu cầu nhiệt độ cao: BaSO4(s) + 4 C(s) → BaS(s) + 4 CO(g)
– Bước 2 yêu cầu trạng thái nóng chảy của các chất phản ứng: BaS + CaCl2 → BaCl2 + CaS
Người ta có thể dùng nước để lọc BaCl2 ra khỏi hỗn hợp. Sau đó tiến hành tách thành tinh thể màu trắng: BaCl2·2H2O từ dung dịch bari clorua, phân tử dihydrat.
4. Bari clorua được ứng dụng trong những lĩnh vực nào?
Muối bari clorua là hợp chất hòa tan trong nước và khá rẻ. Vì vậy trong các phòng thí nghiệm và các ngành công nghiệp sản xuất chúng được sử dụng rộng rãi với nhiều ứng dụng tuyệt vời:
Trong phòng thí nghiệm nghiên cứu: BaCl2 được dùng để kiểm tra sự có mặt của ion sunfat.
Đối với lĩnh vực công nghiệp và sản xuất:
– Dùng trong sản xuất muối để xử lý nhiệt hoặc làm cứng thép.
– Có tác dụng làm sạch dung dịch nước muối.
– Dùng làm chất ổn định PVC, bari cromat hoặc dầu bôi trơn.
– Chủ yếu được sử dụng trong một số nhà máy xút để làm sạch dung dịch nước muối. Còn được dùng trong sản xuất thép, muối xử lý nhiệt, dùng trong sản xuất muối bari và sản xuất bột màu.
– Tạo màu hợp pháp hóa. Tuy nhiên, do tính độc của Bari clorua nên ứng dụng của nó sẽ bị hạn chế.
– Ngoài ra Bari clorua còn được dùng trong điều chế thuốc trừ sâu, thuốc diệt chuột, dùng để khử CaSO4 trong nước lò hơi.

Hình 3: Bari clorua dùng trong thí nghiệm
5. BaCl2 có độc không? Những lưu ý khi sử dụng và bảo quản Bari clorua
Độc tính của Bari Clorua (BaCl2) đã được xác định. Vì vậy, trong quá trình sử dụng hợp chất hóa học vô cơ này phải được bảo quản đúng cách và cẩn thận. Khi sử dụng và bảo quản BaCl2 cần tuân thủ những nguyên tắc sau:
– Bảo quản Bari Clorua trong thùng chứa chuyên dụng, để nơi khô ráo, thoáng mát.
– Tránh tiếp xúc với Bari Clorua (BaCl2) với các chất oxy hóa và axit mạnh.
– Khi sử dụng hợp chất cần tuân thủ đầy đủ các phương pháp an toàn và trang bị bảo hộ lao động như kính, găng tay, khẩu trang,…
Thông qua những nội dung được chia sẻ ở trên trong bài viết, chúng tôi hy vọng đã cung cấp cho bạn đọc khái niệm về Bacl2 là gì. Ngoài ra, nếu muốn sử dụng loại hóa chất này an toàn và hiệu quả thì bạn nên chọn mua ở những người bán BaCl2 uy tín, chất lượng.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn