Nội dung bài viết
Ankan là các hydrocacbon bão hòa, không vòng, trong đó phân tử chỉ chứa các liên kết đơn CC hoặc CH (CnH2n+2). Metan (CH4) là ankan đơn giản nhất. Trong nội dung bài viết LabTrường Chu Văn An sẽ chia sẻ những thông tin cụ thể về Alkanes với các bạn.
1. Ankan là gì?
Ankan là các hydrocacbon bão hòa, mạch hở, trong đó phân tử chỉ chứa các liên kết đơn CC hoặc CH. Công thức chung của ankan là CnH2n+2 (với n ≥ 1).
Metan (CH4) là ankan đơn giản nhất.
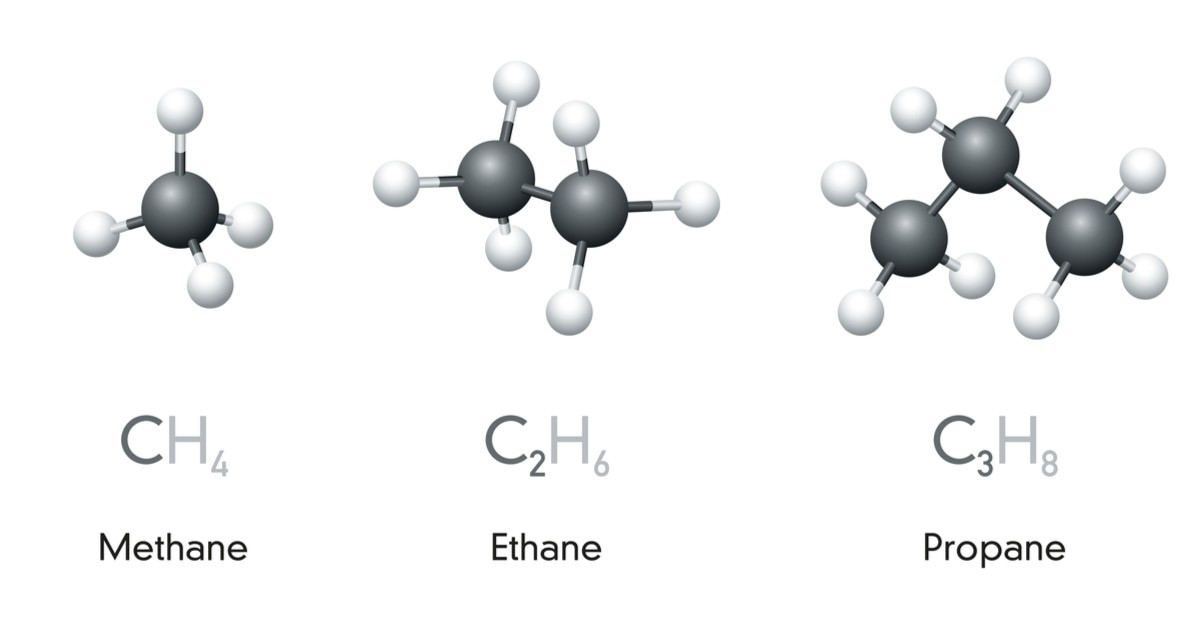
Hình 1: Ankan là hydrocacbon bão hòa, mạch hở
2. Tính đồng nhất – Đồng phân – Tên ankan
2.1. Tương đồng của ankan
Các hợp chất như CH4, C2H6, C3H8, C4H10, C5H12,… thuộc dãy đồng đẳng của Ankan. Có công thức tổng quát CnH2n+2 (với n ≥ 1). Đây là những hydrocacbon mạch hở, có cấu trúc phân nhánh hoặc không phân nhánh. Trong phân tử ankan chỉ xuất hiện liên kết CC và CH. Trong phân tử ankan (trừ CH4), các nguyên tử cacbon không nằm thẳng hàng.
2.2. Đồng phân của ankan
Đối với ankan có từ 4 nguyên tử cacbon trở lên. Tức là từ C4H10 trở đi xuất hiện các đồng phân mạch cacbon. Mỗi công thức phân tử tương ứng với một loại hợp chất có cấu trúc mạch cacbon phân nhánh và cấu trúc mạch cacbon không phân nhánh. Đây là một loại đồng phân cấu trúc của ankan.
Tên của ankan (danh pháp)
Cách gọi tên mạch cacbon thẳng là Ankan: Gọi tên mạch cacbon + an. Bao gồm:
- CH4: Mêtan
- C2H6: Êtan
- C3H8: Propane
- C4H10: Butan
- C5H12: Pentan
- C6H14: Hexan
- C7H16: Heptan
- C8H18: Octane
- C9H20: Nonan
- C10H22: Decan
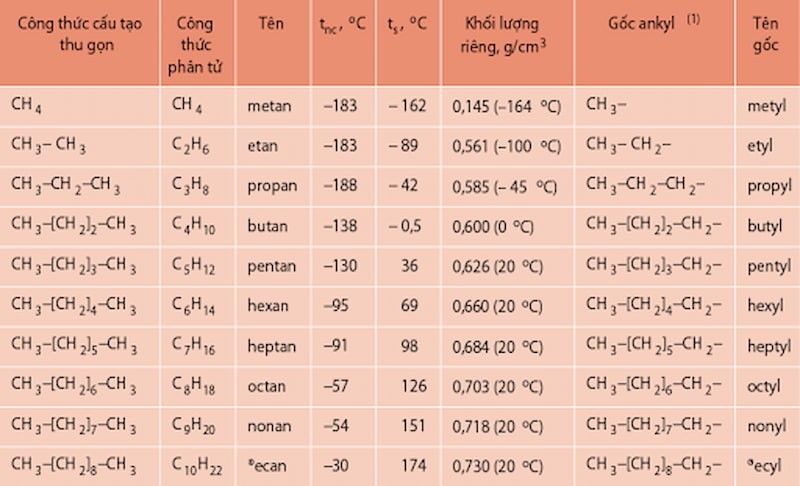
Hình 2: Tên các ankan (danh pháp)
Cách gọi tên Ankan khi mạch cacbon có nhánh: Vị trí mạch nhánh + tên nhánh + tên mạch chính (Tên Ankan tương ứng với số nguyên tử cacbon trong mạch chính).
3. Tính chất vật lý của Ankan
Ankan có những tính chất vật lý nổi bật sau:
- Ở điều kiện phòng, 4 ankan đầu tiên trong dãy đồng đẳng từ CH4 đến C4H10 tồn tại dưới dạng khí. Tiếp theo, các ankan chuyển sang trạng thái lỏng và từ C18H38 trở đi, chúng tồn tại dưới dạng chất rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi cũng như mật độ của ankan tăng dần khi khối lượng phân tử tăng.
- Mật độ của ankan thường nhẹ hơn nước. Hầu hết các ankan đều không tan trong nước mà chỉ tan trong dung môi hữu cơ.
- Ankan thường là dung môi không phân cực, có khả năng hòa tan trong các chất không phân cực như benzen, dầu mỡ,…

Hình 3: Tính chất vật lý của Ankan
4. Tính chất hóa học của ankan
Trong điều kiện bình thường, ankan thường không phản ứng với dung dịch axit, dung dịch kiềm và chất oxy hóa. Tuy nhiên, khi đun nóng hoặc chiếu sáng, chúng có thể dễ dàng tham gia vào các phản ứng thay thế, phản ứng tách hydro và phản ứng đốt cháy. Dưới đây là ba loại phản ứng hóa học điển hình của ankan:
4.1. Phản ứng thay thế bằng halogen (Cl2, Br2)
Khi một ankan như metan được chiếu sáng hoặc đun nóng trong môi trường clo, các nguyên tử hydro có thể được thay thế tuần tự bằng clo. Phản ứng hóa học của ankan diễn ra như sau:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
4.2. Phản ứng tách ankan
4.2.1. Phản ứng tách ankan H2
Phản ứng tách H2 của ankan hay còn gọi là phản ứng dehydro hóa diễn ra theo công thức chung: CnH2n+2 → CnH2n + H2. Chỉ những ankan có ít nhất 2 nguyên tử cacbon mới có thể tham gia phản ứng này.
Trong phản ứng tách H2, hai nguyên tử Hydrogen gắn với hai nguyên tử Carbon liền kề sẽ tách ra khỏi nhau và thường ưu tiên tách Hydrogen khỏi nguyên tử Carbon cấp cao hơn.
Phương trình hóa học:
- CH3-CH2-CH3 → CH2=CH-CH3 + H2
Một số trường hợp đặc biệt:
- CH3-CH2-CH2-CH3 → 2H2 + CH2=CH-CH=CH2
- CH3-CH(CH3)-CH2-CH3 → CH2=C(CH3)-CH=CH2 + 2H2
- n-C6H14 → 4H2 + C6H6 (Benzen)
- n-C7H16 → 4H2 + C6H5CH3 (Toluen)
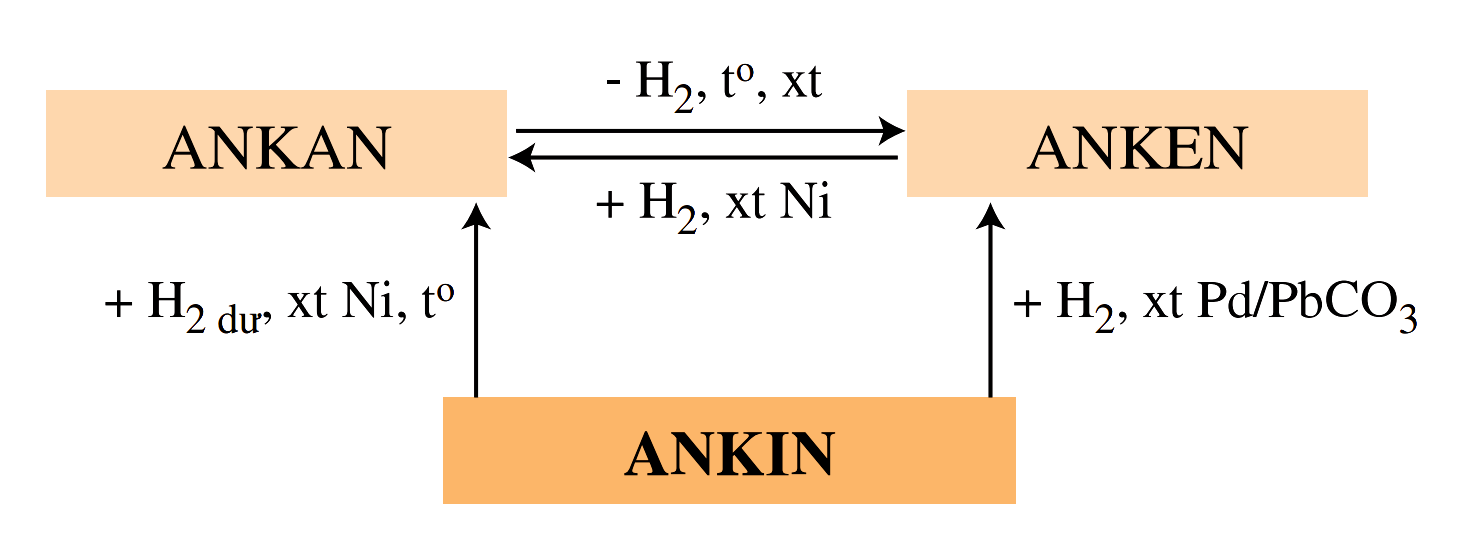
Hình 4: Tính chất hóa học của Ankan
4.2.2. Phản ứng crackinh của ankan (n ≥ 3)
Phản ứng tách chuỗi cacbon của ankan, hay phản ứng Cracking. Phản ứng này xảy ra trong điều kiện nhiệt độ, áp suất và xúc tác thích hợp. Công thức chung của phản ứng là: CnH2n+2 → CxH2x+2 + CyH2y.
Ankan thẳng CnH2n+2 khi trải qua quá trình Cracking có thể chia thành (n – 2) mạch khác nhau, tạo ra 2 (n – 2) sản phẩm. Số mol ankan sau phản ứng luôn bằng số mol ankan ban đầu mặc dù quá trình Cracking có nhiều giai đoạn.
Ankan có thể bị phân hủy bởi nhiệt. Công thức chung của phản ứng phân hủy là: CnH2n+2 → nC + (n+1)H2. Đồng thời, phản ứng phân hủy cũng có thể xảy ra khi ankan phản ứng với halogen, có công thức tổng quát: CnH2n+2 + nCl2 → CnCl2n+2 + (n+1)H2.
4.2.3. Phản ứng cháy của ankan
Phản ứng oxy hóa ankan, còn được gọi là phản ứng đốt cháy ankan, diễn ra khi ankan tương tác với các tác nhân oxy hóa ở nhiệt độ phòng. Tuy nhiên, ở nhiệt độ cao hoặc khi có chất xúc tác, ankan có thể phản ứng với oxy, KMnO4, K2Cr2O7 tạo thành các sản phẩm như: Rượu, Aldehyt, Xeton, Axit cacboxylic…
Công thức chung cho phản ứng cháy của Ankan là: CnH2n+2 → CnH2n + H2
Khi thực hiện phản ứng đốt cháy ankan cần lưu ý hai điểm quan trọng sau:
- Lượng CO2 sinh ra luôn nhỏ hơn lượng H2O.
- Hiệu số giữa số mol H2O và số mol CO2 bằng số mol ankan bị đốt cháy.
Nếu kết quả phản ứng cháy cho thấy số mol CO2 nhỏ hơn số mol H2O thì hiđrocacbon cháy thuộc loại ankan. Trường hợp đốt cháy hỗn hợp hiđrocacbon mà số mol CO2 nhỏ hơn số mol H2O thì hỗn hợp cháy sẽ chứa ít nhất một ankan.
LabTrường Chu Văn An vừa chia sẻ những thông tin liên quan đến Alkanes với các bạn qua bài viết. Hy vọng bài viết của Labvietchem đã mang đến những thông tin hữu ích cho các bạn.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn