Nội dung bài viết
Liên kết cộng hóa trị là một trong những loại liên kết hóa học phổ biến nhất, làm cơ sở cho cấu trúc và tính chất của vô số hợp chất. Tuy nhiên, không phải ai cũng hiểu rõ bản chất và đặc điểm của loại kết nối này. Hãy cùng LabvietCHEM khám phá sâu hơn về loại kết nối quan trọng này nhé.
1. Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị là “cầu nối” giữa các nguyên tử, ion hoặc phân tử, được hình thành khi chúng có chung một hoặc nhiều cặp electron. Mỗi cặp electron dùng chung này hoạt động như một “cây cầu nhỏ” nối hai thực thể lại với nhau, tạo ra liên kết hóa học. Chính nhờ sự chia sẻ electron mà nguyên tử có thể đạt được cấu hình electron ổn định, góp phần cấu tạo nên vô số phân tử đa dạng trong tự nhiên.
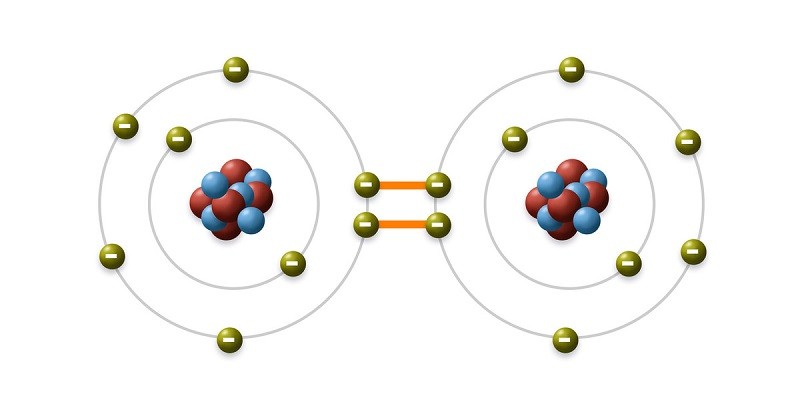
Hình 1: Liên kết cộng hóa trị được hình thành bởi hai nguyên tử có một hoặc nhiều cặp electron dùng chung
2. Phân loại liên kết cộng hóa trị
2.1 Liên kết cộng hóa trị có cực
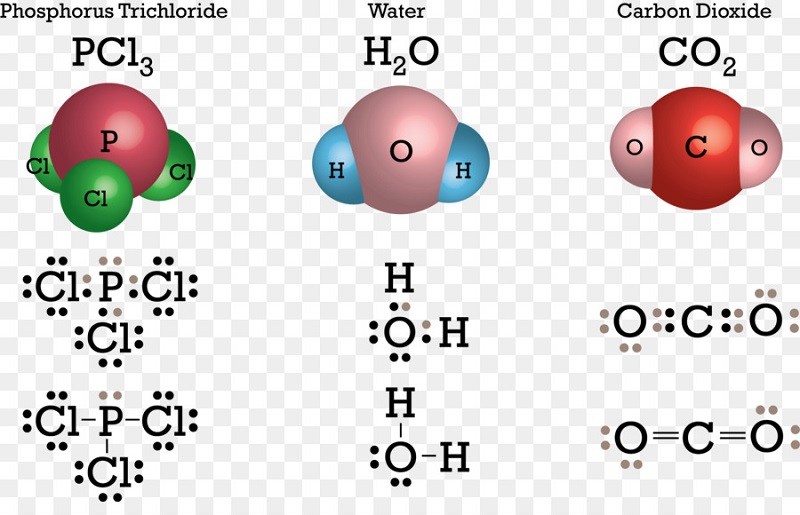
Liên kết cộng hóa trị có cực hình thành khi sự chia sẻ electron giữa các nguyên tử không đồng đều. Nguyên nhân chính là do sự khác biệt về độ âm điện giữa các nguyên tử liên kết. Các nguyên tử có độ âm điện lớn hơn sẽ hút cặp electron dùng chung về phía mình mạnh hơn, tạo ra cực âm. Ngược lại, nguyên tử còn lại sẽ mang điện tích dương một phần, tạo thành cực dương. Sự phân bố điện tích không đồng đều này tạo ra một lưỡng cực điện trong phân tử.
2.2 Liên kết cộng hóa trị không phân cực
Liên kết cộng hóa trị không phân cực được hình thành khi các nguyên tử liên kết chia sẻ các electron một cách cân bằng. Điều này xảy ra khi cả hai nguyên tử có độ âm điện gần như bằng nhau, tác dụng một lực hút tương đương lên cặp electron dùng chung. Do đó, cặp electron không bị lệch về phía bất kỳ nguyên tử nào, dẫn đến phân tử không phân cực. Mặt khác, điều này cũng xảy ra ở các phân tử khí (diatomic). Hạt có độ âm điện cao sẽ hút các electron ra khỏi phía yếu hơn.
Hình 2: Liên kết cộng hóa trị là không phân cực nếu các electron được chia sẻ bằng nhau
2.3 Liên kết phân tử đơn
Liên kết đơn là một loại liên kết hóa học hình thành khi hai nguyên tử có chung một cặp electron. So với liên kết đôi và liên kết ba, liên kết đơn có cấu trúc đơn giản hơn, mật độ electron thấp hơn và năng lượng liên kết nhỏ hơn. Tuy nhiên, chính sự đơn giản này đã mang lại cho liên kết đơn một ưu điểm đặc biệt: độ ổn định cao. Vì chỉ có một cặp electron tham gia liên kết nên liên kết đơn ít bị phá vỡ khi bị tác động bởi các yếu tố bên ngoài.
2.4 Liên kết đôi phân tử
Trong khi liên kết đơn được hình thành khi hai nguyên tử dùng chung một cặp electron thì liên kết đôi được tạo ra khi hai nguyên tử đó dùng chung hai cặp electron. Liên kết đôi được thể hiện bằng hai đường nối hai nguyên tử, tượng trưng cho hai cặp electron dùng chung. Mặc dù mạnh hơn liên kết đơn nhưng liên kết đôi kém ổn định hơn và dễ bị phá vỡ trong các phản ứng hóa học.
2.5 Liên kết ba phân tử
Liên kết ba là liên kết cộng hóa trị kém ổn định nhất. Liên kết này xảy ra khi ba cặp electron được chia sẻ giữa hai nguyên tử của phân tử.
3. Đặc điểm của liên kết cộng hóa trị
Liên kết cộng hóa trị có những đặc điểm nổi bật sau:
3.1 Hình thức tồn tại
Các chất có liên kết cộng hóa trị có thể tồn tại ở nhiều trạng thái vật lý khác nhau, từ chất rắn như đường, sắt, lưu huỳnh đến chất lỏng như rượu, nước và các chất khí như hydro, clo, carbon dioxide. Sự đa dạng này phụ thuộc vào nhiều yếu tố như cấu trúc phân tử, lực liên phân tử và điều kiện nhiệt độ.
3.2 Chất phân cực
Các chất phân cực như đường, rượu etylic… sẽ tan trong dung môi phân cực như nước.
3.3 Các chất không phân cực
Các chất không phân cực như ion, lưu huỳnh… sẽ tan trong các dung môi không phân cực như benzen, cacbon tetraclorua…
Những chất chỉ có liên kết cộng hóa trị không phân cực thì không thể dẫn điện ở bất kỳ trạng thái nào.
Hình 3: Liên kết cộng hóa trị không phân cực có thể dẫn điện
4. Phương pháp nhận biết liên kết cộng hóa trị và liên kết ion
4.1 Đặc điểm của liên kết ion
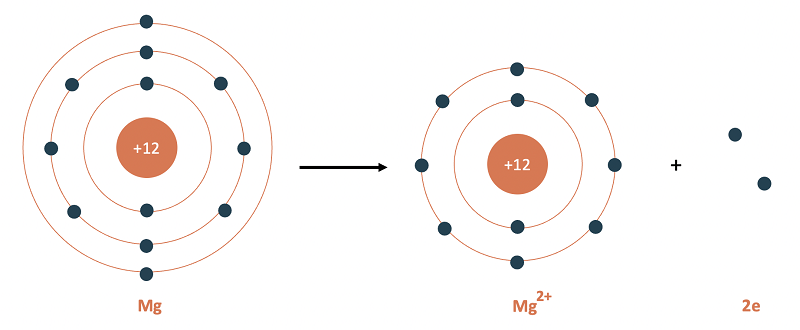
- Liên kết ion được tạo ra giữa hai nguyên tử khác nhau, trong đó một nguyên tử nhường electron cho nguyên tử khác.
- Vì mỗi nguyên tử có ít electron hơn và nguyên tử kia có thêm một nguyên tử nên hai nguyên tử này trở thành ion.
- Ion kim loại mất electron sẽ mang điện tích dương và ion phi kim loại nhận electron sẽ mang điện tích âm. Điều này dẫn đến việc các ion bị hút mạnh vào nhau để tạo thành liên kết.
- Các hợp chất ion thường sẽ ở dạng rắn như muối. Nhờ điểm nóng chảy cao khi hòa tan trong nước nên nó tạo ra tính dẫn điện cao.

Hình 4. Sự khác biệt về liên kết ion
4.2 Đặc điểm của liên kết cộng hóa trị
- Liên kết cộng hóa trị hình thành khi hai nguyên tử chia sẻ electron để đạt được cấu hình electron ổn định của khí hiếm.
- Sở dĩ hình thành liên kết cộng hóa trị là do các nguyên tử tham gia liên kết thường có xu hướng đạt cấu hình electron ổn định của khí hiếm.
- Chia sẻ electron giúp nguyên tử đạt được sự ổn định hóa học.
Trên đây là những thông tin chi tiết về liên kết cộng hóa trị mà LabTrường Lê Hồng Phong muốn chia sẻ đến các bạn. Hy vọng những kiến thức này sẽ giúp ích cho quá trình học tập, nghiên cứu của các bạn. Nếu bạn có bất kỳ câu hỏi nào chưa được giải đáp, vui lòng liên hệ ngay với chúng tôi. Labvietchem luôn sẵn sàng hỗ trợ bạn mọi lúc, mọi nơi.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn