Nội dung bài viết
Ethanol, thường được biết đến với tên gọi rượu etylic hay cồn etylic (C2H5OH) hay C2H6O, là một hợp chất hữu cơ quen thuộc nhưng lại mang trong mình vai trò vô cùng quan trọng và đa dạng trong nhiều lĩnh vực. Từ thành phần chính trong đồ uống có cồn, dung môi phổ biến trong công nghiệp, nhiên liệu sinh học tiềm năng đến chất sát trùng thiết yếu trong y tế, Ethanol có mặt ở hầu khắp các lĩnh vực.
Bài viết dưới đây, được biên soạn bởi các chuyên gia hóa học của Trường Chu Văn An, sẽ cung cấp một cái nhìn toàn diện về Ethanol, từ công thức cấu tạo, tính chất đặc trưng, các phương pháp sản xuất, cho đến những ứng dụng đa ngành và các lưu ý quan trọng về an toàn khi sử dụng.

I. Etanol(Ethanol) Là Gì? Định Nghĩa và Cấu Trúc Hóa Học
Định nghĩa và Các tên gọi phổ biến
Etanol (C₂H₆O) là một hợp chất hữu cơ thuộc nhóm ancol no, đơn chức, mạch hở, thường xuất hiện dưới dạng chất lỏng không màu, dễ bay hơi và có mùi đặc trưng. Đây là loại rượu phổ biến nhất trong đời sống hiện nay.
Trong danh pháp quốc tế IUPAC, etanol có tên gọi chính thức là Ethanol. Ngoài ra, nó còn được biết đến với các tên thông dụng như rượu etylic, cồn etylic, và trong dân gian gọi là rượu ngũ cốc – do được sản xuất truyền thống từ quá trình lên men tinh bột trong các loại ngũ cốc như gạo, sắn, ngô,…
Công thức hóa học và Cấu trúc phân tử (CTPT, CTCT)
Việc hiểu rõ công thức và cấu trúc phân tử của Etanol (Ethanol) là nền tảng quan trọng để nắm bắt các tính chất vật lý – hóa học cũng như các ứng dụng thực tiễn của hợp chất này.
- Công thức phân tử (CTPT): C₂H₆O
- Công thức cấu tạo thu gọn (CTCT): CH₃CH₂OH hoặc C₂H₅OH
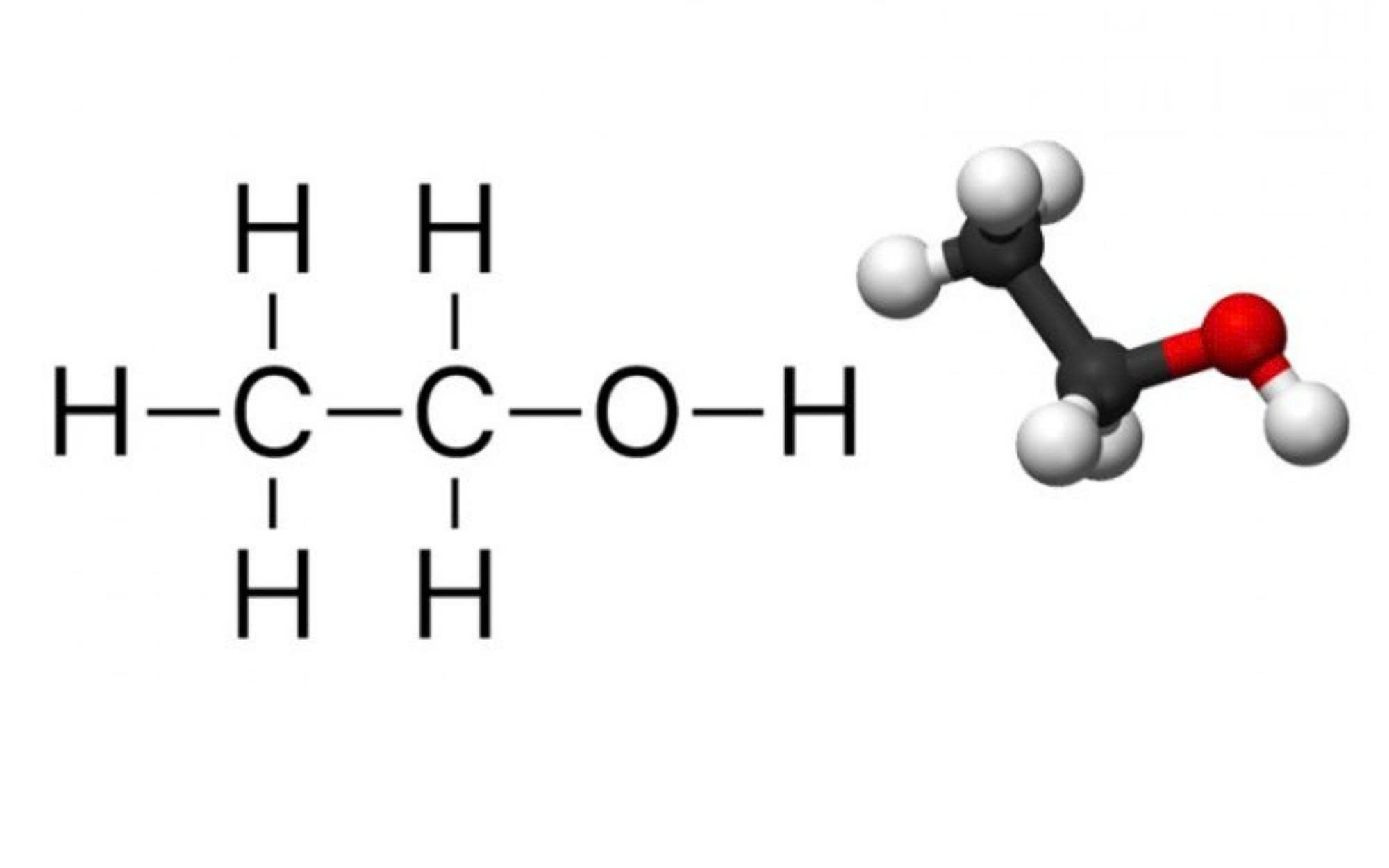
Công thức hóa học và Cấu trúc phân tử của Etanol
Cấu trúc này thể hiện rõ sự hiện diện của nhóm hydroxyl (-OH) – nhóm chức đặc trưng của các ancol. Chính nhóm –OH này quyết định phần lớn tính chất hóa học đặc trưng của Etanol như:
- Tính phân cực cao
- Khả năng tạo liên kết hydro
- Tính tan tốt trong nước
- Tham gia phản ứng oxi hóa, tách nước, este hóa,…
II. Tính Chất Đặc Trưng Của Etanol
Etanol sở hữu những tính chất vật lý và hóa học đặc trưng, giúp nó trở thành một hợp chất hữu cơ linh hoạt và hữu ích trong nhiều lĩnh vực.

Tính chất vật lý (màu sắc, mùi, nhiệt độ sôi/đông đặc, độ tan, khối lượng riêng)
Etanol ở điều kiện thường là một chất lỏng không màu, trong suốt. Nó có mùi đặc trưng dễ nhận biết (mùi rượu) và vị cay, hơi ngọt.
Các tính chất vật lý quan trọng của Etanol khác bao gồm:
- Nhiệt độ sôi của Etanol khá thấp so với nước, vào khoảng 78,37∘C.
- Nhiệt độ đông đặc rất thấp, ở mức −114,1∘C, làm cho Etanol được sử dụng trong các ứng dụng chống đông.
- Khả năng tan: Etanol có khả năng tan vô hạn trong nước. Điều này là do khả năng tạo liên kết hydrogen mạnh mẽ giữa nhóm -OH của Etanol với các phân tử nước. Tính chất này cũng giúp nó tan tốt trong dung môi hữu cơ phân cực nhẹ như: ether, acetone, chloroform,…Chính điều này giúp Etanol trở thành một dung môi đa năng trong hóa học, công nghiệp dược và mỹ phẩm.
- Khối lượng riêng của Etanol: Nhẹ hơn nước, khoảng 0.789g/cm3 ở 20∘C.
Tính chất hóa học quan trọng
Etanol thể hiện các tính chất hóa học đặc trưng của nhóm chức hydroxyl (-OH) và liên kết C-H, C-C.
- Phản ứng cháy: Etanol là một chất dễ cháy, tỏa ra lượng nhiệt lớn khi cháy hoàn toàn trong không khí, tạo thành carbon dioxide và nước. Phương trình phản ứng là: C2H5OH+3O2→2CO2+3H2O+nhiệt. Đây là cơ sở cho ứng dụng Ethanol làm nhiên liệu sinh học (bioethanol) thay thế xăng dầu trong giao thông vận tải.

- Phản ứng với kim loại mạnh (ví dụ Natri – Na): Nhóm -OH trong Etanol có tính axit rất yếu, nhưng vẫn có thể phản ứng với các kim loại kiềm mạnh như Natri, giải phóng khí hidro. Phản ứng này chứng tỏ sự linh động của nguyên tử Hydro trong nhóm hydroxyl. PTPƯ: 2C2H5OH+2Na→2C2H5ONa+H2↑
- Phản ứng thế nhóm -OH (Este hóa): Etanol phản ứng với axit cacboxylic, điển hình là axit axetic (CH₃COOH) trong môi trường H₂SO₄ đặc, đun nóng, tạo este etyl axetat – hợp chất có mùi thơm dễ chịu.
- C2H5OH+CH3COOH⇌CH3COOC2H5+H2O (trong môi trường H2SO4 đặc, đun nóng) Este thường có mùi thơm đặc trưng, được ứng dụng trong sản xuất hương liệu, mỹ phẩm và dược phẩm.
- Phản ứng tách nước (Dehydration): Khi đun nóng Etanol với axit sulfuric đặc, phản ứng tách nước có thể xảy ra theo hai hướng tùy thuộc vào nhiệt độ:
- Tách nước nội phân tử (tạo anken): Ở nhiệt độ cao (khoảng 170∘C), một phân tử nước bị tách khỏi một phân tử Etanol, tạo thành etilen (một anken) và nước. C2H5OH ——> C2H4+H2O (trong môi trường H2SO4 đặc,170∘C )
- Tách nước liên phân tử (tạo ete): Ở nhiệt độ thấp hơn (khoảng 140∘C), hai phân tử Etanol tách một phân tử nước, tạo thành dietyl ete. 2C2H5OH— —->C2H5OC2H5+H2O (trong môi trường H2SO4 đặc 140∘C).
- Phản ứng oxi hóa (không hoàn toàn): Etanol có thể bị oxi hóa không hoàn toàn dưới tác dụng của các chất oxi hóa nhẹ hoặc vi sinh vật.
- Oxi hóa bởi CuO: Khi đun nóng hơi Etanol đi qua đồng(II) oxit nóng, Etanol bị oxi hóa thành anđehit axetic (acetaldehyde). C2H5OH+CuO——> (t∘)CH3CHO+Cu+H2O
- Lên men giấm: Trong điều kiện có men giấm (vi khuẩn Acetobacter) và oxy, Etanol trong rượu có thể bị oxi hóa thành axit axetic (giấm). CH3CH2OH+O2 (men giấm) —->CH3COOH+H2O
Bảng tổng hợp
|
Phản ứng |
Sản phẩm chính |
Ứng dụng điển hình |
|
Cháy hoàn toàn |
CO₂ + H₂O |
Nhiên liệu sinh học |
|
Với kim loại kiềm |
Muối ancolat + H₂ |
Điều chế hợp chất trung gian |
|
Este hóa |
Este + H₂O |
Hương liệu, mỹ phẩm |
|
Tách nước |
Etilen hoặc Dietyl ete |
Công nghiệp nhựa, dung môi |
|
Oxi hóa |
Andehit / Axit axetic |
Tổng hợp hữu cơ, lên men giấm |
III. Các Phương Pháp Sản Xuất Etanol Phổ Biến
Etanol không chỉ tồn tại tự nhiên mà còn được sản xuất rộng rãi trong công nghiệp để đáp ứng nhu cầu đa dạng trong đời sống và sản xuất. Có hai phương pháp chính để điều chế etanol trong công nghiệp:
- Từ nguồn sinh học (lên men sinh học)
- Từ nguồn hóa thạch (tổng hợp hóa học)
Sản xuất từ nguồn sinh học (Lên men tinh bột/xenlulozo)
Đây là phương pháp truyền thống lâu đời nhất, còn được gọi là sản xuất cồn sinh học (bioethanol).
➤ Quy trình:
Phương pháp này sử dụng nguyên liệu thực vật giàu tinh bột (như ngô, sắn, khoai mì, gạo) hoặc nguyên liệu chứa xenlulozo (như rơm rạ, bã mía, gỗ vụn). Các bước chính gồm:
- Thủy phân tinh bột hoặc xenlulozo → Đường đơn (glucose)
- Lên men yếm khí: Đường đơn được chuyển hóa thành etanol và khí CO₂ nhờ enzyme từ nấm men Saccharomyces cerevisiae.
- Phương trình tổng quát: C6H12O6(men rượu)—>2C2H5OH+2CO2
Sản xuất từ nguồn hóa thạch (Tổng hợp từ Etylen)
Đây là phương pháp hiện đại, ứng dụng phổ biến trong công nghiệp để sản xuất Etanol với quy mô lớn và hiệu suất cao.
➤ Quy trình:
Etanol được tổng hợp bằng cách hiđrat hóa etylen (C₂H₄) – một sản phẩm từ quá trình chưng cất dầu mỏ. Phản ứng này cần:
- Nhiệt độ và áp suất cao
- Xúc tác axit: thường phản ứng với axit là H₂SO₄ hoặc H₃PO₄
- Phương trình: C2H4+H2O (H2SO4 đặc,t∘)-->C2H5OH

So sánh hai phương pháp
Để có cái nhìn tổng quan, dưới đây là bảng so sánh chi tiết hai phương pháp điều chế Etanol trong công nghiệp:
|
Tiêu Chí So Sánh |
Phương Pháp Lên Men (Sinh học) |
Phương Pháp Tổng Hợp (Từ Etylen) |
|
Nguyên liệu |
Tinh bột, xenlulozo (tái tạo) |
Etylen (từ dầu mỏ, không tái tạo) |
|
Hiệu suất |
Thấp hơn, phụ thuộc vào quá trình lên men |
Cao, ổn định |
|
Tốc độ sản xuất |
Chậm |
Nhanh |
|
Độ tinh khiết |
Cần tinh chế nhiều |
Cao hơn, ít tạp chất |
|
Chi phí |
Có thể thấp hơn ở quy mô nhỏ |
Đầu tư thiết bị ban đầu cao, chi phí vận hành lớn |
|
Tác động môi trường |
Thân thiện hơn (nếu quản lý chất thải tốt) |
Phụ thuộc vào nguồn gốc etylen |
IV. Ứng Dụng Đa Dạng Của Etanol Trong Đời Sống và Công Nghiệp
Nhờ vào các tính chất đặc trưng như khả năng cháy, tính chất dung môi và khả năng tham gia phản ứng hóa học, Etanol có mặt trong hầu hết mọi lĩnh vực, từ những sản phẩm quen thuộc hàng ngày đến các ngành công nghiệp mũi nhọn.
Ngành Nhiên liệu (Xăng E5, nhiên liệu sinh học)
Etanol được dùng rộng rãi làm nhiên liệu sinh học (bioethanol) hoặc chất pha trộn với xăng dầu truyền thống. Các loại xăng pha cồn như E5 (5% Etanol, 95% xăng) và E10 (10% Etanol, 90% xăng) ngày càng phổ biến, trong đó có Việt Nam.
- Ưu điểm: Giúp giảm sự phụ thuộc vào nhiên liệu hóa thạch, giảm phát thải khí nhà kính do nguồn Etanol từ sinh khối tái tạo, đồng thời làm xăng cháy sạch hơn, hạn chế ô nhiễm.
- Nhược điểm: Hàm lượng Etanol có thể ảnh hưởng đến hiệu suất động cơ nếu không tương thích. Việc sản xuất bioethanol quy mô lớn cũng có thể gây cạnh tranh nguồn lương thực.

Ngành Dung môi (hòa tan, chất tẩy rửa)
Với khả năng tan vô hạn trong nước và khả năng hòa tan nhiều chất hữu cơ khác, Etanol là một dung môi hữu cơ phân cực cực kỳ phổ biến.
- Etanol là dung môi hữu cơ phân cực được sử dụng trong sản xuất sơn, vecni, mực in, keo dán, và các loại chất kết dính. Trong hóa mỹ phẩm, Etanol là thành phần chính trong nước hoa, các sản phẩm chăm sóc da (toner, sữa rửa mặt) và keo xịt tóc.
- Etanol được dùng trong các loại chất tẩy rửa gia dụng và công nghiệp nhờ khả năng hòa tan dầu mỡ và tính khử trùng hiệu quả.
Ngành Y tế và Dược phẩm (Sát trùng, dung môi bào chế)
Vai trò của Etanol trong y tế là không thể thiếu, đặc biệt là khả năng sát trùng, diệt khuẩn.
- Chất sát trùng: Cồn Etanol với nồng độ phổ biến là 70% hoặc 90% được dùng để sát trùng da, dụng cụ y tế. Etanol làm biến tính protein của vi khuẩn và virus, tiêu diệt chúng hiệu quả. (Gợi ý: Trích dẫn nguồn từ Bộ Y tế hoặc WHO về khuyến nghị sử dụng cồn sát khuẩn).
- Dung môi bào chế thuốc: Etanol được dùng làm dung môi để chiết xuất các hoạt chất từ dược liệu, bào chế thuốc (ví dụ: một số loại thuốc ho, siro), và sản xuất thuốc xịt ngoài da.
- Thuốc giải độc: Trong một số trường hợp ngộ độc methanol, Etanol được dùng như một chất giải độc cạnh tranh.
Ngành Thực phẩm và Đồ uống (Rượu, giấm)
Đây là ứng dụng quen thuộc nhất của Etanol đối với đa số mọi người.
- Đồ uống có cồn: Etanol là thành phần chính tạo nên đặc tính của tất cả các loại đồ uống có cồn, từ rượu, bia đến các loại rượu mạnh. Hàm lượng Etanol quyết định độ cồn của sản phẩm.
- Sản phẩm trung gian: Etanol là nguyên liệu quan trọng trong sản xuất giấm ăn thông qua quá trình lên men axit axetic (tạo CH3COOH từ C2H5OH).
Quá trình tổng hợp trong hóa học và các lĩnh vực ứng dụng liên quan
Etanol còn là một nguyên liệu đầu vào quan trọng trong công nghiệp hóa chất để tổng hợp nhiều hóa chất hữu cơ khác như:
- Eten (từ phản ứng tách nước).
- Dietyl ete (từ phản ứng tách nước).
- Axit axetic (từ oxi hóa Etanol).
- Este (từ phản ứng este hóa).
- Butadien – nguyên liệu chính trong sản xuất cao su tổng hợp
- Các hợp chất hữu cơ có clo (ví dụ: cloroform). Các ứng dụng nhỏ lẻ khác bao gồm làm chất chống đông trong hệ thống làm mát, chất lỏng trong nhiệt kế.
V. Phân Loại Etanol: Các Cấp Độ Tinh Khiết và Mục Đích Sử Dụng
Trên thị trường hiện nay, Etanol không chỉ có một loại duy nhất mà được phân loại theo các cấp độ tinh khiết khác nhau, phù hợp với từng mục đích sử dụng chuyên biệt. Việc hiểu rõ sự khác biệt này là rất quan trọng để giúp bạn đảm bảo hiệu quả công việc và an toàn khi sử dụng. Dưới đây là Bảng Tổng Hợp: Phân Loại Etanol Theo Độ Tinh Khiết và Mục Đích Sử Dụng
|
Loại Etanol |
Độ Tinh Khiết Tiêu Biểu |
Thành Phần Đặc Trưng |
Mục Đích Sử Dụng Chính |
Lưu Ý Quan Trọng |
|
Etanol Tuyệt đối |
>99.5% hoặc 99.9% |
Rất ít hoặc không có nước |
Phòng thí nghiệm (phân tích, nghiên cứu), công nghiệp điện tử, nhiên liệu cao cấp |
Yêu cầu phương pháp điều chế đặc biệt, giá thành cao |
|
Etanol Biến tính |
Thường 95% – 99.5% |
Đã thêm chất biến tính (methanol, isopropanol, chất tạo mùi/vị đắng) |
Dung môi công nghiệp (sơn, mực, keo), nhiên liệu công nghiệp |
Tuyệt đối không được uống, độc hại, không dùng trong y tế/thực phẩm |
|
Etanol Y tế |
70%, 90% |
Đạt tiêu chuẩn dược phẩm, không tạp chất độc hại |
Sát trùng, khử khuẩn, bào chế thuốc |
Phải đạt chuẩn Pharmacopoeia, không dùng cho mục đích uống |
|
Etanol Thực phẩm |
Cao, không tạp chất độc hại |
Tuân thủ các quy định về an toàn thực phẩm |
Sản xuất đồ uống có cồn, hương liệu, phụ gia thực phẩm |
Phải đảm bảo an toàn tuyệt đối khi tiêu thụ |
|
Etanol Công nghiệp |
Đa dạng, có thể thấp hơn |
Tùy thuộc ứng dụng, có thể chứa tạp chất (bao gồm cả Etanol biến tính) |
Dung môi công nghiệp tổng hợp, nguyên liệu sản xuất hóa chất |
Không dùng cho người, không dùng trong thực phẩm/y tế |
VI. Mua Etanol ở đâu? Trường Chu Văn An – Địa chỉ uy tín, chất lượng hàng đầu
Việc chọn nhà cung cấp Etanol uy tín, đảm bảo chất lượng và an toàn là rất quan trọng đối với doanh nghiệp, phòng thí nghiệm và cơ sở sản xuất. Trường Chu Văn An tự hào là đối tác tin cậy hàng đầu trong lĩnh vực cung ứng Etanol và hóa chất công nghiệp tại Việt Nam.
Tại sao chọn Trường Chu Văn An để mua Etanol?
- Uy tín và kinh nghiệm lâu năm: Trường Chu Văn An có thương hiệu vững chắc, hoạt động chuyên nghiệp, minh bạch và tuân thủ nghiêm ngặt các tiêu chuẩn ngành hóa chất.
- Chất lượng sản phẩm đảm bảo: Etanol do Trường Chu Văn An cung cấp có nguồn gốc rõ ràng, được kiểm soát chất lượng nghiêm ngặt với đầy đủ giấy tờ chứng nhận COA, đạt tiêu chuẩn ASTM, USP, JP,… và hoàn toàn không lẫn tạp chất gây hại.
- Dịch vụ tư vấn chuyên sâu: Đội ngũ chuyên gia luôn hỗ trợ kỹ thuật, giúp khách hàng chọn loại Etanol phù hợp với nhu cầu và quy trình sản xuất.
- Hệ thống phân phối hiện đại: Trường Chu Văn An có mạng lưới kho bãi và vận chuyển nhanh chóng, đảm bảo giao hàng an toàn và kịp thời trên toàn quốc.

vietchem
Các loại Etanol chất lượng cao tại Trường Chu Văn An
Cam kết an toàn và hỗ trợ kỹ thuật từ Trường Chu Văn An
- Tư vấn cách lưu trữ và vận chuyển Etanol an toàn, tuân thủ các quy định pháp luật.
- Hỗ trợ kỹ thuật chuyên sâu để tối ưu hóa hiệu quả sử dụng và bảo vệ môi trường làm việc.
VII. Ethanol – Hợp Chất Đa Năng Cho Tương Lai Bền Vững
Etanol (Ethanol, rượu etylic, C₂H₅OH) là một hợp chất hữu cơ đa năng không thể thiếu trong đời sống và công nghiệp hiện đại. Từ cấu trúc phân tử đặc trưng đến các tính chất vật lý và hóa học đa dạng, Etanol đã khẳng định vai trò quan trọng của mình.
Chúng ta đã tìm hiểu về hai phương pháp sản xuất chính là lên men sinh học và tổng hợp từ etylen, cùng ưu nhược điểm của từng quy trình. Ethanol có mặt trong nhiều ứng dụng như nhiên liệu sinh học, dung môi công nghiệp, chất sát trùng y tế, và thành phần chính trong đồ uống có cồn. Việc phân loại Etanol theo các cấp độ tinh khiết (tuyệt đối, biến tính, y tế, thực phẩm, công nghiệp) giúp hiểu rõ mục đích sử dụng và tiêu chuẩn chất lượng.
Trường Chu Văn An, với kinh nghiệm và uy tín hàng đầu trong cung ứng hóa chất, cam kết mang đến Etanol đạt tiêu chuẩn cao nhất, phục vụ từ phòng thí nghiệm đến sản xuất công nghiệp. Liên hệ Trường Chu Văn An để được tư vấn giải pháp Etanol và hóa chất tối ưu cho hoạt động của bạn.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn