Nội dung bài viết
Phản ứng giữa SO₂ + NaOH là một trong những phản ứng kinh điển và quan trọng nhất trong hóa học vô cơ và các ứng dụng công nghiệp. Nó không chỉ là kiến thức cơ bản trong sách giáo khoa mà còn là chìa khóa của nhiều quy trình xử lý môi trường và sản xuất hóa chất quy mô lớn. Bài viết này dưới góc nhìn của một chuyên gia 20 năm kinh nghiệm của VietChem sẽ đi sâu vào bản chất, cách cân bằng phương trình và những ứng dụng thực tế không thể bỏ qua của phản ứng này.

I. Phương trình hóa học SO₂ + NaOH
Cân bằng phương trình SO₂ + NaOH
Tùy theo tỉ lệ mol giữa NaOH và SO2, ta có hai trường hợp phản ứng chính:
Trường hợp 1: Tỷ lệ mol nSO2/nNaOH ≥2
Khi lượng NaOH dư hoặc tỷ lệ mol đạt từ 2 trở lên, phản ứng tạo ra một loại muối trung tính gọi là natri sulfite (Na2SO3).
SO2 + 2NaOH → Na2SO3 + H2O
- Phương trình này đã được cân bằng. Ta thấy có 1 nguyên tử S, 2 nguyên tử Na, 4 nguyên tử O và 2 nguyên tử H ở hai bên.
Trường hợp 2: Tỉ lệ mol nSO2/nNaOH ≤ 1
Khi dư SO2 hoặc tỷ lệ mol bằng 1, phản ứng tạo ra muối axit gọi là natri bisulfit (NaHSO3).
SO2 + NaOH→ NaHSO3
Bảng so sánh 2 trường hợp phản ứng
|
Tỷ lệ mol (T=nSO2/nNaOH) |
Phương trình phản ứng |
Sản phẩm chính |
Tên sản phẩm |
|
T 1 |
SO2 + NaOH → NaHSO3 |
Muối axit |
Natri bisulfite (natri hydrosulfite) |
|
1 < T < 2 |
Cả hai phản ứng đều xảy ra |
Hỗn hợp 2 muối |
NaHSO3 và Na2SO3 |
|
T ≥ 2 |
SO2 + 2NaOH → Na2SO3 + H2O |
Muối trung tính |
Natri sunfit |
II. Cơ chế phản ứng giữa SO₂ và NaOH
Theo lý thuyết axit-bazơ Arrhenius, cơ chế phản ứng có thể được giải thích như sau:
- NaOH là bazơ mạnh, phân ly hoàn toàn trong nước tạo thành ion Na+ và ion OH− hydroxit.
- SO2 là oxit axit. Khi hòa tan trong nước, nó phản ứng tạo ra axit sunfuric (H2SO3), một axit yếu.
- Phản ứng trung hòa xảy ra giữa các ion H+ (từ H2SO3) và các ion OH− (từ NaOH) để tạo ra nước (H2O). Các ion còn lại (Na+ và SO32− hoặc HSO3−) kết hợp với nhau tạo thành muối.
Nói một cách đơn giản, đây là cuộc “gi giằng co” giữa axit và bazơ. Nếu bazơ mạnh và dồi dào (tỷ lệ ≥2) sẽ “trung hòa” hoàn toàn axit, tạo ra muối trung tính Na2SO3. Nếu bazơ không đủ mạnh hoặc không đủ dồi dào (tỷ lệ ≤1) thì chỉ có thể “trung hòa một phần” tạo thành muối axit NaHSO3.
III. Phản ứng SO₂ + NaOH
Về bản chất, đây là phản ứng trung hòa giữa oxit axit (sulfur dioxide – SO2) và bazơ mạnh (natri hydroxit – NaOH). Khi khí SO2 sủi bọt vào dung dịch NaOH chúng sẽ phản ứng với nhau tạo thành muối và nước.
Điểm đặc biệt của phản ứng này là sản phẩm tạo thành (muối natri sulfite Na2SO3 hoặc natri bisulfite NaHSO3) phụ thuộc hoàn toàn vào tỷ lệ mol giữa SO2 và NaOH. Đặc tính này đã mở ra nhiều ứng dụng thực tiễn, nổi bật nhất là công nghệ xử lý khí thải SO2 từ các nhà máy công nghiệp và sản xuất các hóa chất phái sinh.
IV. Tính chất hóa học của SO₂ và NaOH
Để hiểu được phản ứng, trước tiên chúng ta cần nắm được bản chất của hai “nhân vật” chính.
Tính chất hóa học của SO₂ (Lưu huỳnh đioxit)
SO2 là gì? Đây là một oxit axit, tồn tại ở dạng khí không màu, có mùi hăng đặc trưng (mùi diêm cháy). Khí này hòa tan trong nước tạo thành axit sunfuric (H2SO3), một axit yếu và không ổn định.
SO2+ H2O ⇌ H2SO3
Ngoài tính axit, SO2 còn thể hiện cả tính khử (khi phản ứng với chất oxy hóa mạnh như KMnO4, Br2) và tính oxy hóa (khi phản ứng với chất khử mạnh như H2S).
Tính chất hóa học của SO₂
Bảng tóm tắt các tính chất của SO₂
|
Thuộc tính |
Chi tiết |
|
Trạng thái |
Khí không màu, mùi hăng |
|
Khối lượng mol |
≈64,07 g/mol |
|
Độ hòa tan trong nước |
9,4 g/100 mL ở 25°C (hòa tan tốt, tạo thành axit) |
|
Tính chất hóa học chính |
Oxit axit, tính khử, tính oxi hóa |
|
Độc tính |
Độc, gây kích ứng đường hô hấp |
Tính chất hóa học của NaOH (Natri hydroxit)
NaOH là gì? Thường được gọi là xút, NaOH là một trong những bazơ mạnh nhất. Nó tồn tại ở dạng rắn (vảy, viên, hạt), màu trắng, có tính hút ẩm cực mạnh (dễ tan khi tiếp xúc với không khí) và tỏa nhiệt rất lớn khi hòa tan trong nước.
NaOH ăn mòn da, giấy và nhiều kim loại (như nhôm và kẽm), vì vậy hãy hết sức cẩn thận khi sử dụng. Nó là một hóa chất cơ bản trong nhiều ngành công nghiệp như sản xuất giấy, sản xuất xà phòng, dệt nhuộm và xử lý nước.

Soda mảnh NaOH
Bảng tóm tắt tính chất của NaOH
|
Thuộc tính |
Chi tiết |
|
Trạng thái |
Chất rắn (vảy, viên, hạt), màu trắng |
|
Khối lượng mol |
≈40,00 g/mol |
|
Độ hòa tan trong nước |
109 g/100 mL ở 20°C (tan chảy rất tốt, tỏa nhiệt mạnh) |
|
Tính chất hóa học chính |
Bazơ chắc chắn, hút ẩm mạnh, có tính ăn mòn cao |
|
Ứng dụng chính |
Sản xuất xà phòng, giấy, tơ tổng hợp kết hợp xử lý nước |
V. Sản phẩm của phản ứng SO₂ + NaOH và ý nghĩa thực tiễn
- Natri Sulfite (Na2SO3): Là chất khử, được sử dụng rộng rãi làm chất khử oxy trong xử lý nước lò hơi, chống ăn mòn. Trong công nghiệp giấy, nó được sử dụng trong quá trình nghiền sulfite. Nó cũng là tiền chất để sản xuất natri thiosulfate (Na2S2O3).
- Natri Bisunfit (NaHSO3): Được biết đến với mã phụ gia thực phẩm E222, là chất bảo quản hiệu quả, ngăn chặn sự phát triển của vi khuẩn và chống oxy hóa (chống thâm đen) cho trái cây sấy khô và rượu vang. Ngoài ra, NaHSO3 còn được sử dụng làm chất tẩy trắng trong sản xuất giấy và dệt.
VI. Ứng dụng phản ứng SO₂ + NaOH trong thực tế
Xử lý khí thải SO₂ trong công nghiệp
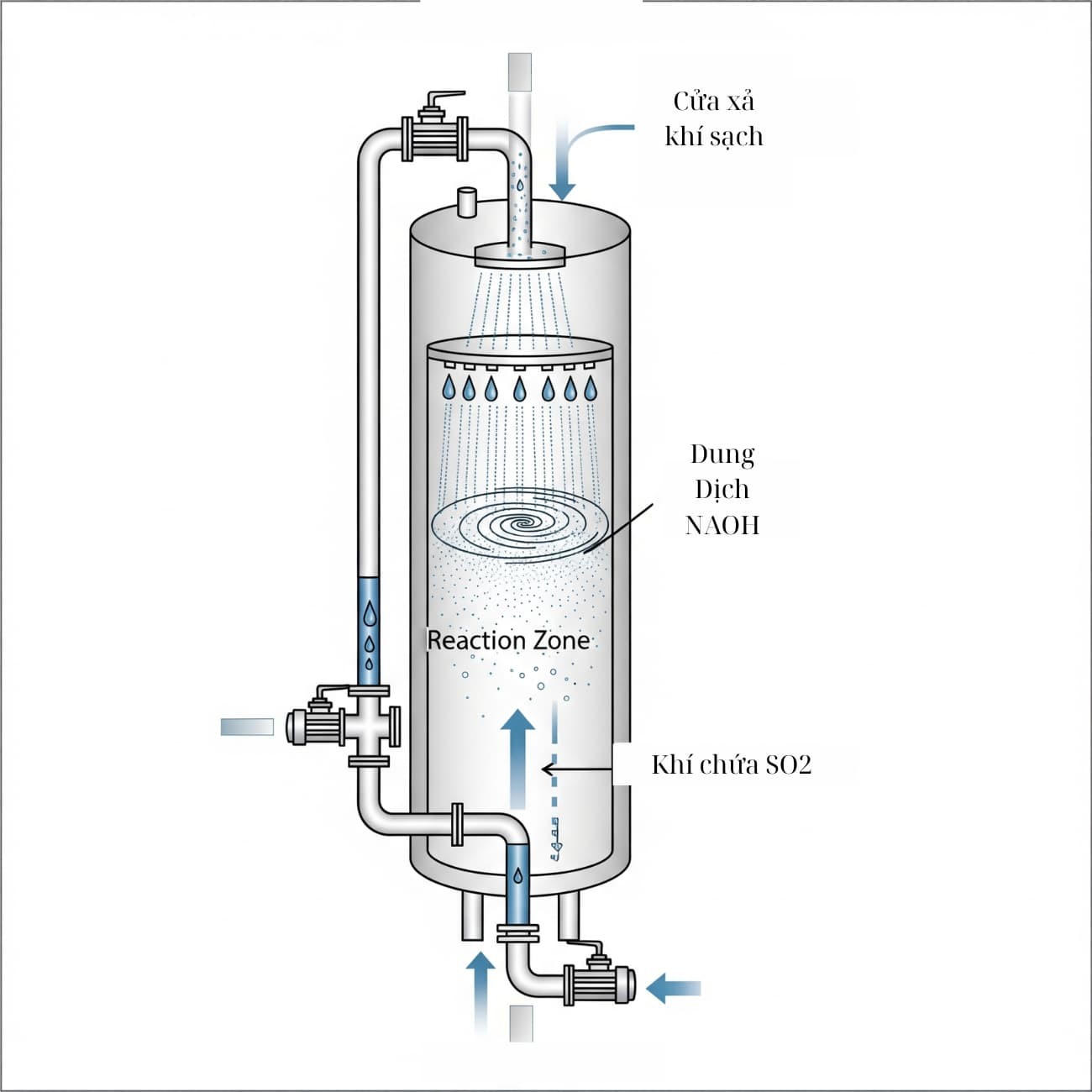
Đây được coi là một ứng dụng quan trọng. Khí SO2 sinh ra từ quá trình đốt nhiên liệu hóa thạch (than, dầu) trong các nhà máy nhiệt điện và luyện kim là nguyên nhân chính gây ra mưa axit. Để xử lý, người ta sử dụng tháp hấp thụ (máy lọc) chứa dung dịch NaOH.
- Quy trình: Khí thải chứa SO2 được dẫn qua tháp từ dưới lên. Dung dịch NaOH được phun từ trên xuống dưới. Tại đây xảy ra phản ứng SO2+NaOH “giữ lại” SO2 dưới dạng muối sunfit/bisulfit, làm sạch khí thải trước khi thải ra môi trường.
- Tham khảo: Các quy trình này phải tuân thủ nghiêm ngặt các tiêu chuẩn khí thải công nghiệp như QCVN 19:2009/BTNMT của Việt Nam hay hướng dẫn của EPA (Cơ quan Bảo vệ Môi trường Hoa Kỳ).
Ứng dụng phản ứng SO₂ + NaOH trong xử lý khí thải SO₂ trong công nghiệp
Sản xuất hóa chất và các ứng dụng khác
- Tổng hợp muối: Phản ứng này là phương pháp chủ yếu để sản xuất công nghiệp Na2SO3 và NaHSO3 phục vụ cho các ngành công nghiệp khác.
- Phòng thí nghiệm: Dùng để định lượng SO2 hoặc pha chế các dung dịch chuẩn.
VII. Bài tập và ví dụ liên quan đến SO₂ + NaOH
Bài 1 (Tính): Đun 4,48 lít khí SO2 (điều kiện tiêu chuẩn) vào dung dịch chứa 20 gam NaOH. Tính khối lượng muối thu được.
- Phần thưởng:
- nSO2=22,44,48=0,2 (mol)
- nNaOH=4020=0,5 (mol)
- Xét tỉ số T=nSO2nNaOH=0,20,5=2,5
- Vì T>2 nên phản ứng tạo ra muối Na2SO3 và NaOH dư.
- Phương trình: SO2 + 2NaOH → Na2SO3 + H2O
- Theo phương trình, nNa2SO3 = nSO2 = 0,2 (mol)
- Khối lượng muối thu được: mNa2SO3 = 0,2×(23×2+32+16×3) = 0,2×126=25,2 (gam)
Bài 2 (Cân bằng nâng cao): Cho thấy sản phẩm tạo thành khi cho V lít khí SO2 sủi bọt từ từ vào dung dịch chứa 1 mol NaOH.
- Giải pháp: Đây là một vấn đề tranh luận. Kết quả phụ thuộc vào tỷ số T=a/(V/22.4). Dựa vào bảng so sánh trên để kết luận sản phẩm là NaHSO3, Na2SO3 hay hỗn hợp của cả hai.
VIII. Kết luận
Phản ứng SO2+NaOH không chỉ là một phương trình hóa học. Đó là minh chứng cho sự kết nối chặt chẽ giữa khoa học lý thuyết và ứng dụng thực tiễn, từ bảo vệ môi trường đến sản xuất công nghiệp. Sự hiểu biết sâu sắc về nó giúp chúng tôi tối ưu hóa quy trình và tạo ra các sản phẩm có giá trị.
Để đảm bảo sự thành công cho các ứng dụng của bạn, VietChem luôn sẵn sàng là đối tác tin cậy, cung cấp NaOH và các hóa chất liên quan với chất lượng và dịch vụ tốt nhất trên thị trường.
>>> Xem thêm  :
:
Nhiên liệu là gì? Loại nào? Vai trò trong cuộc sống?
Axit clohiđric HCl là gì? Phương pháp điều chế và sản xuất axit clohydric


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn