Nội dung bài viết
Trong bài viết này, Trường Chu Văn An sẽ giúp bạn giải mã mọi khía cạnh của Oxy (O2) – không chỉ là loại khí dễ thở mà còn là thành phần nền tảng của vô số ngành công nghiệp hiện đại. Với 20 năm kinh nghiệm trong ngành hóa chất, chúng tôi không chỉ cung cấp sản phẩm mà còn mang đến những kiến thức chuyên sâu và chân thực nhất. Hãy cùng khám phá câu chuyện khoa học kỳ thú và những ứng dụng bất ngờ của Oxy ngay dưới đây
Oxy (O2) là gì? Định nghĩa & Khái niệm cơ bản
Định nghĩa khoa học của O2 là gì?
Oxy, thường được biết đến với công thức hóa học O2, là nguyên tố hóa học trong bảng tuần hoàn có ký hiệu O và số nguyên tử 8. Trong điều kiện tiêu chuẩn, Oxy tồn tại ở dạng phân tử gồm hai nguyên tử liên kết với nhau (công thức O2), tạo thành chất khí không màu, không mùi, không vị. Nó là một phi kim rất dễ phản ứng và là chất oxy hóa có khả năng dễ dàng tạo thành oxit với hầu hết các nguyên tố khác.
Ký hiệu hóa học của Oxi là gì? Tại sao lại là O2?
Góc nhìn sâu sắc từ Trường Chu Văn An: Một lỗi thường gặp là gọi chữ “O” cho khí Oxy. Trên thực tế, “O” là biểu tượng cho nguyên tử Riêng oxy, một dạng không ổn định và có tính phản ứng cao. Trong tự nhiên, để đạt được trạng thái ổn định hơn, hai nguyên tử Oxy sẽ kết hợp với nhau tạo thành phân tử O2, còn được gọi là dioxygen. Đây là dạng khí Oxy mà chúng ta hít thở và tồn tại chủ yếu trong khí quyển
Lịch sử khám phá oxy?
Lịch sử phát hiện ra Oxy là một câu chuyện hấp dẫn về sự cạnh tranh và khám phá khoa học. Mặc dù nó được nhà hóa học người Thụy Điển Carl Wilhelm Scheele phát hiện vào năm 1772 nhưng công trình của ông đã được xuất bản sau đó. Vì vậy, nhà hóa học người Anh Joseph Priestley thường được cho là đã khám phá ra Oxy vào năm 1774.
Tuy nhiên, chính Antoine Lavoisier, nhà hóa học vĩ đại người Pháp, đã bác bỏ lý thuyết nhiên tố sai lầm vào thời của ông và đặt tên cho nguyên tố này là “oxygène”. Từ này xuất phát từ các từ tiếng Hy Lạp “oxys” (axit) và “gen” (tạo ra), bởi vì ông tin rằng Oxy là thành phần tạo ra tất cả các axit.
Tính chất vật lý và hóa học của oxy (O2)
Các đặc tính vật lý và hóa học độc đáo của O2 là chìa khóa mở ra vô số ứng dụng trong tự nhiên và công nghiệp.
Tính chất vật lý của O2: Không chỉ là chất khí vô hình

Tính chất vật lý của O2
Ở điều kiện tiêu chuẩn, khí Oxi không màu, không mùi, không vị và hơi nặng hơn không khí. Tuy nhiên, khi thay đổi nhiệt độ và áp suất, O2 thể hiện những trạng thái vô cùng thú vị.
- Hình thức & Màu sắc: Khi hóa lỏng ở -183 °C, Oxy lỏng có màu xanh nhạt, một hình ảnh quen thuộc trong các ứng dụng công nghiệp và hàng không vũ trụ. Ở trạng thái rắn (-218,79 °C), nó tồn tại dưới dạng tinh thể màu xanh nhạt.
- Độ hòa tan trong nước: Oxy ít tan trong nước nhưng lượng nhỏ này cực kỳ quan trọng, đủ để duy trì sự sống trong toàn bộ hệ sinh thái dưới nước.
Bảng các thông số vật lý chính của Oxy (O2)
|
Thuộc tính |
Giá trị |
|
Khối lượng phân tử |
32,00 g/mol |
|
Nhiệt độ sôi |
-183°C (90,15K) |
|
Nhiệt độ nóng chảy |
-218,79 °C (54,36 K) |
|
Mật độ (khí, 0°C, 1atm) |
1.429 g/L |
|
Mật độ (lỏng, ở -183°C) |
1,141 g/cm³ |
Tính chất hóa học của O2: Giải mã bản chất chất oxy hóa mạnh
Trường Chu Văn An nhấn mạnh: Cấu hình electron của nguyên tử Oxy (2 lớp, 6 electron ở lớp ngoài cùng) khiến nó có xu hướng mạnh mẽ nhận thêm 2 electron để đạt được cấu hình ổn định. Đây là gốc rễ của quá trình oxy hóa mạnh – tính chất hóa học quan trọng nhất của Oxy.
- Tác dụng với kim loại: Hầu hết các kim loại (trừ Vàng, Bạch kim…) đều phản ứng với Oxy ở nhiệt độ bình thường hoặc cao, tạo ra oxit. Phản ứng quen thuộc nhất là làm gỉ sắt: 4Fe+3O2→2Fe2O3.
- Tác dụng với phi kim: O2 phản ứng mạnh với nhiều phi kim khi bị tác dụng bởi nhiệt độ, tạo ra oxit axit. Ví dụ kinh điển là đốt lưu huỳnh để tạo ra khí Lưu huỳnh: S+O2→SO2.
- Tác dụng lên các hợp chất: Oxy có khả năng oxy hóa nhiều hợp chất vô cơ và hữu cơ. Phản ứng đốt cháy khí metan (CH₄) trong không khí là một ví dụ: CH4+2O2→CO2+2H2O. Phản ứng này giải phóng một lượng nhiệt lớn, là cơ sở của nhiều loại động cơ và nguồn năng lượng.
Tìm hiểu thêm: Phản ứng oxi hóa khử là gì?
Khí Oxy có vai trò gì trong cuộc sống?
Vai trò của oxy vô cùng rộng lớn, từ việc duy trì hơi thở cho đến vận hành những cỗ máy công nghiệp khổng lồ.
Trong Sinh học & Y học: Không chỉ dành cho hơi thở
- Quá trình hô hấp: Oxy là “nhiên liệu” cuối cùng trong chuỗi hô hấp tế bào, giúp giải phóng năng lượng (ATP) từ thức ăn để duy trì mọi hoạt động sống.
- Liệu pháp oxy: Trong y học, khí oxy tinh khiết được sử dụng trong bình thở để cung cấp cho bệnh nhân bị suy hô hấp, ngộ độc Carbon Monoxide (CO), hoặc trong quá trình phẫu thuật và gây mê.
Ứng dụng đột phá của oxy (O2) trong công nghiệp hiện đại

Ứng dụng đột phá của oxy (O2) trong công nghiệp hiện đại
- Công nghiệp luyện kim: Đây là một trong những ứng dụng lớn nhất của oxy. Thổi Oxy nguyên chất vào lò luyện thép giúp loại bỏ tạp chất (Carbon, Silicon…) nhanh và hiệu quả hơn, nâng cao chất lượng thép.
- Hàn cắt kim loại (Oxy-Acetylen): Ngọn lửa đốt cháy khí Axetylen trong dòng Oxy nguyên chất có thể đạt nhiệt độ trên 3.200°C, đủ nóng để làm nóng chảy các tấm thép dày.
- Công nghiệp hóa chất: Oxy là nguyên liệu thiết yếu để sản xuất ra hàng loạt các hóa chất quan trọng như Axit Nitric (HNO₃), Ethylene Oxide, Hydrogen Peroxide (H₂O₂)… Đây là lĩnh vực chuyên môn sâu của Trường Chu Văn An.
- Xử lý nước thải: Sục khí O2 vào bể xử lý sinh học giúp thúc đẩy vi sinh vật hiếu khí phân hủy chất hữu cơ, làm sạch nguồn nước.
- Nhiên liệu tên lửa: Oxy lỏng (LOX) là chất oxy hóa phổ biến nhất được sử dụng trong động cơ tên lửa, kết hợp với các loại nhiên liệu như hydro lỏng (LH2) để tạo ra lực đẩy cực lớn.
Các dạng thù hình của oxy: O2 và O3 (Ozone)
Oxy không chỉ tồn tại ở dạng O2. Một dạng khác của nó có vai trò cực kỳ quan trọng đó là Ozone (O3).
Bảng so sánh nhanh Oxy (O2) và Ozone (O3)
|
Tiêu chuẩn |
Ôxi (O2) |
Ozon (O3) |
|
Kết cấu |
Chứa 2 nguyên tử oxi |
Gồm 3 nguyên tử oxi |
|
Thiên nhiên |
Duy trì sự sống, ít độc tính |
Có tính oxi hóa rất mạnh, độc ở nồng độ cao |
|
Mùi |
không mùi |
Mùi tanh, chát đặc trưng (thường có mùi sau mưa, sấm sét) |
|
Vai trò chính |
Duy trì hô hấp và đốt cháy |
Bảo vệ Trái đất khỏi tia UV, ứng dụng khử trùng |
Phân tử oxy (O2): Nguồn oxy của sự sống
Đây là dạng phổ biến nhất, chiếm khoảng 21% thể tích khí quyển và là thành phần không thể thiếu trong quá trình hô hấp của hầu hết sinh vật trên Trái đất.
Ozone (O3): “lá chắn” và con dao hai lưỡi của Trái đất
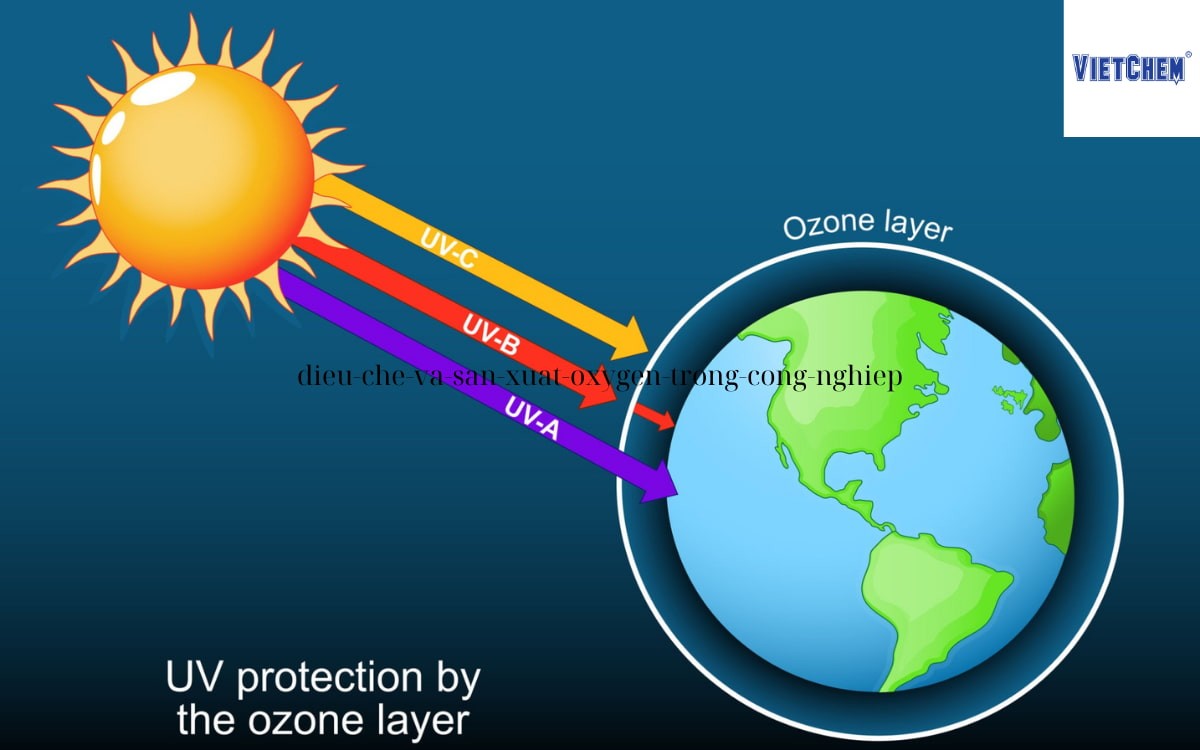
Khí ozone tập trung chủ yếu ở tầng bình lưu, tạo thành tầng Ozone nổi tiếng. Lớp này có tác dụng như một tấm chắn, hấp thụ hầu hết các tia cực tím (UV) có hại từ Mặt trời. Tuy nhiên, ở tầng đối lưu (gần mặt đất), Ozone là chất gây ô nhiễm, có hại cho hệ hô hấp. Nhờ đặc tính oxy hóa cực mạnh nên Ozone được ứng dụng trong công nghệ khử trùng xử lý nước, không khí, nước thải.
Chuẩn bị và sản xuất oxy trong công nghiệp
Để đáp ứng nhu cầu rất lớn, Oxy được sản xuất trên quy mô lớn bằng phương pháp chính là chưng cất phân đoạn không khí lỏng. Quá trình này bao gồm các bước sau: làm sạch không khí → hóa lỏng không khí bằng cách nén và làm mát sâu → đưa không khí lỏng vào cột chưng cất. Vì Nitơ có nhiệt độ sôi thấp hơn (-196 °C) so với Oxy (-183 °C) nên Nitơ sẽ bay hơi trước, để lại Oxy lỏng nguyên chất.
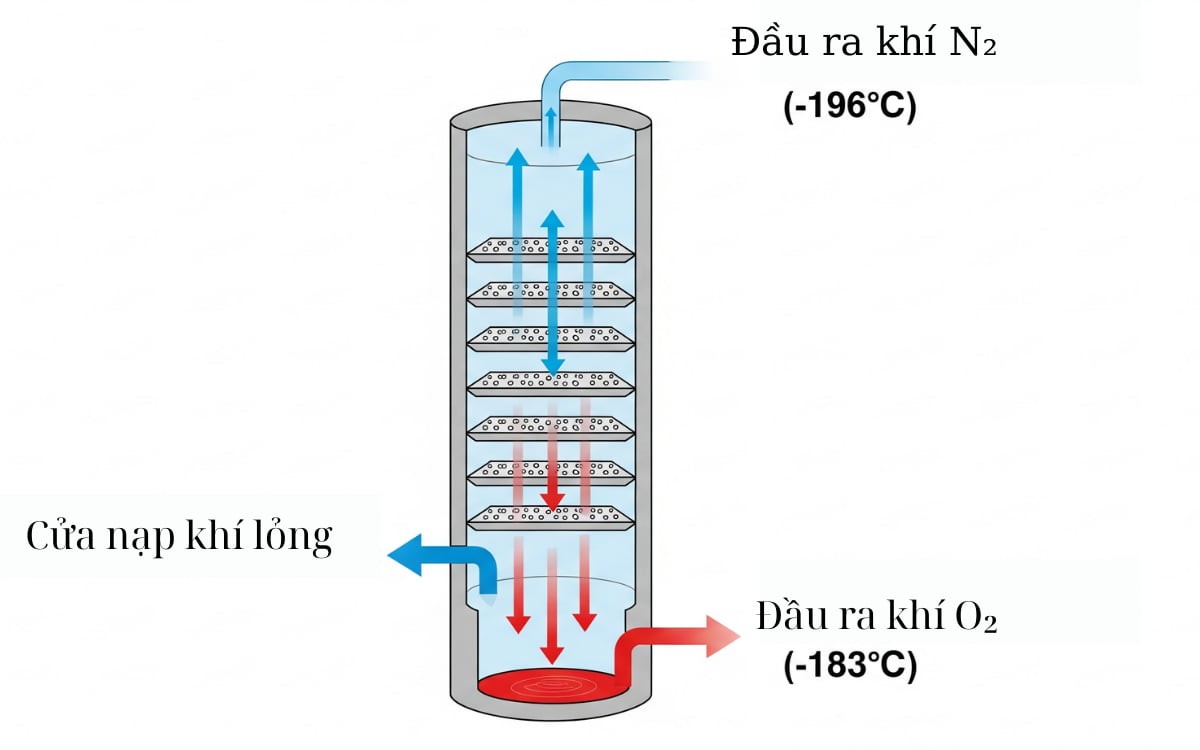
Chuẩn bị và sản xuất oxy trong công nghiệp
An Toàn Khi Sử Dụng Và Bảo Quản Khí Oxy – Hướng Dẫn Từ Chuyên Gia vietchem
Mặc dù không tự cháy nhưng Oxy là chất cực mạnh có khả năng duy trì quá trình cháy. Vì vậy, an toàn luôn cần được đặt lên hàng đầu.
- Nguy cơ cháy nổ: Áp suất cao trong bể và khả năng bắt lửa khi tiếp xúc với vật liệu dễ cháy (đặc biệt là dầu mỡ) là nguy cơ lớn nhất. Tuyệt đối không để dầu mỡ dính vào van bình hoặc các thiết bị sử dụng Oxy. Trong môi trường giàu Oxy và áp suất cao, dầu mỡ có thể tự bốc cháy mà không cần nguồn nhiệt, gây cháy nổ cực kỳ nguy hiểm.
- Quy tắc an toàn:
- Bảo quản bình oxy nén ở nơi khô ráo, thoáng mát, tránh xa nguồn nhiệt và vật liệu dễ cháy.
- Sử dụng van, đường ống và thiết bị chuyên dụng cho Oxy.
- Mở van từ từ để tránh sự thay đổi áp suất và nhiệt độ đột ngột.
- Duy trì một không gian làm việc thông thoáng với sự lưu thông không khí tốt.
- Ngộ độc oxy có xảy ra không? Có, nhưng rất hiếm trong điều kiện bình thường. Tình trạng này (gây tổn thương phổi và hệ thần kinh) chỉ xảy ra khi hít thở Oxy ở nồng độ và áp suất rất cao trong thời gian dài, thường thấy trong các ứng dụng chuyên dụng như lặn sâu hoặc trị liệu bằng oxy cao áp.
Hỏi đáp nhanh cùng chuyên gia Trường Chu Văn An
Khí Oxi có màu gì và có mùi gì?
Ở dạng khí, Oxy không màu, không mùi, không vị và ở dạng lỏng, nó có màu xanh nhạt.
O2 có phải là không khí không?
Không. O2 chỉ là thành phần của không khí, chiếm khoảng 21%. Hầu hết không khí (78%) là khí Nitơ.
Làm thế nào để xác định khí oxy?
Phương pháp đơn giản nhất trong phòng thí nghiệm là sử dụng que lửa có cặn màu đỏ còn sót lại trên đó. Khi cho vào bình Oxy, que lửa sẽ cháy trở lại.
Mua Oxy công nghiệp nguyên chất, an toàn ở đâu?
Để đảm bảo chất lượng và an toàn, bạn nên tìm đến những nhà cung cấp hóa chất công nghiệp uy tín. vietchem tự hào là nhà cung cấp hàng đầu các sản phẩm khí công nghiệp, trong đó có oxy, có độ tinh khiết cao và tuân thủ nghiêm ngặt các tiêu chuẩn an toàn.
Kết luận
Từ một nguyên tử đơn giản, Oxy (O2) đã chứng tỏ được vai trò không thể thay thế của mình, là sợi dây kết nối sự sống, khoa học và công nghệ. Hiểu được Oxy là gì, từ những đặc tính cơ bản đến những ứng dụng phức tạp, không chỉ là kiến thức về hóa học mà còn là chìa khóa để vận hành an toàn và hiệu quả trong nhiều ngành công nghiệp.
Trường Chu Văn An hy vọng bài viết này đã cung cấp cho bạn cái nhìn toàn diện và chuyên sâu. Chúng tôi cam kết tiếp tục là người bạn đồng hành đáng tin cậy, mang đến không chỉ những sản phẩm chất lượng mà còn cả những kiến thức khoa học đích thực cho cộng đồng và doanh nghiệp.
Nguồn tham khảo: Thông tin về tính chất và lịch sử khám phá được tham khảo, đối chiếu từ các ấn phẩm của Hiệp hội Hóa học Hoàng gia (RSC)
Bách khoa toàn thư Ullmann về hóa học công nghiệp.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn